
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 2.9 | 6.7 | 9.4 | 9.7 |
 .
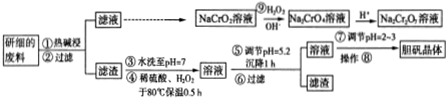
.分析 该废料中含Cu和CuO约占87%,其它为MgO、Cr2O3、FeO、SiO2,其中Cr2O3、SiO2能与碱反应生成Na2SiO3和NaCrO2,过滤得到滤渣为:Cu、CuO、MgO、FeO,水洗至PH=7,加稀硫酸、双氧水于80℃保温0.5h,CuO、MgO、FeO都溶于稀硫酸生成硫酸铜、硫酸镁、硫酸亚铁,铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,调至PH=5.2,沉降1小时,三价铁离子沉淀完全,过滤得到滤渣氢氧化铁和滤液,滤液中含有铜离子和镁离子,经过对滤液蒸发浓缩、冷却结晶、过滤得到产品,蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质.
(1)Fe(OH)3完全沉淀的PH是2.9,c(H+)=10-2.9mol/L,c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-2.9}}$=10-11.1mol/L,金属阳离子离子浓度小于等于10-5mol•L-1时以氢氧化物形式完全沉淀,根据KSP=c(Fe3+)×c3(OH-) 计算;
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为:Cr2O3+2OH-=2CrO2-+H20,
步骤④中铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,
调节pH不能引入新的杂质;
(3)从溶液中得到晶体一般采取蒸发浓缩、冷却结晶、过滤的方法; 整个过程中没有除去金属镁离子,据此写出离子化合物氧化镁的电子式;
(4)步骤⑨中氧化剂是双氧水,还原剂NaCrO2被双氧水氧化成Na2Cr2O7,根据得失电子守恒计算物质的量之比;
Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,根据得失电子守恒和原子守恒写出反应方程式.
解答 解:该废料中含Cu和CuO约占87%,其它为MgO、Cr2O3、FeO、SiO2,其中Cr2O3、SiO2能与碱反应生成Na2SiO3和NaCrO2,过滤得到滤渣为:Cu、CuO、MgO、FeO,水洗至PH=7,加稀硫酸、双氧水于80℃保温0.5h,CuO、MgO、FeO都溶于稀硫酸生成硫酸铜、硫酸镁、硫酸亚铁,铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,调至PH=5.2,沉降1小时,三价铁离子沉淀完全,过滤得到滤渣氢氧化铁和滤液,滤液中含有铜离子和镁离子,经过对滤液蒸发浓缩、冷却结晶、过滤得到产品,蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质.
(1)Fe(OH)3完全沉淀的PH是2.9,c(H+)=10-2.9mol/L,c(OH-)=$\frac{{K}_{W}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-2.9}}$=10-11.1mol/L,金属阳离子离子浓度小于等于10-5mol•L-1时以氢氧化物形式完全沉淀,KSP=c(Fe3+)×c3(OH-)=10-5×(10-11.1)3=10-38.3,
故答案为:10-38.3;
(2)步骤①中Cr2O3能与碱反应,该反应的离子方程式为:Cr2O3+2OH-=2CrO2-+H20,
步骤④中铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,
调节pH不能引入新的杂质,a项会引入钠离子,b、c项物质会和氢离子反应调节pH,同时生成铜离子,不会引入新的杂质,
故答案为:Cr2O3+2OH-=2CrO2-+H20;Cu、Fe2+;bc;
(3)从溶液中得到晶体一般采取蒸发浓缩、冷却结晶、过滤的方法;整个过程中没有除去金属镁离子; MgO是离子化合物,由Mg2+离子和O2-离子构成,MgO的电子式为 ,
,
故答案为:冷却结晶; ;
;
(4)步骤⑨中氧化剂是双氧水,还原剂NaCrO2被双氧水氧化成Na2Cr2O7,3H2O2~6e-,2CrO2-~Cr2O72-~6e-,则氧化剂与还原剂的物质的量之比为3:2,
Na2Cr2O7溶液可以将乙醇氧化为乙酸,本身还原为Cr3+,根据得失电子守恒和原子守恒写出反应方程式:3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4,
故答案为:3:2;3CH3CH2OH+2Na2Cr2O7+8H2SO4=3CH3COOH+2Cr2(SO4)3+11H2O+2Na2SO4.
点评 本题以流程图的形式考查了物质的分离与提纯、离子方程式的书写、水解平衡、氧化还原反应等知识,分离和提纯时一定不能引入新的杂质,调节pH一般加入含提纯物质中的离子的化合物,避免引入新的杂质,如本题制取胆矾晶体,用CuO、Cu(OH)2调节pH,除去杂质,难度适中.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 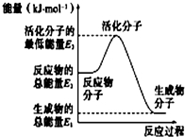 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | C2H6 | C. | C2H4 | D. | C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶 | |
| B. | 用图1所示装置可从KI和I2的固体混合物中回收I2 | |
| C. | 用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O | |
| D. | 用图3所示装置除去Cl2中含有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
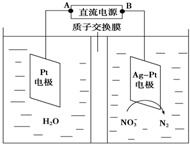 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A. | 若以铅蓄电池做电源进行电解,Pt电极为阴极 | |
| B. | 电解过程中H+向正极移动 | |
| C. | 若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.2g | |
| D. | 理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com