
| A. | 2.24L CO2中含有的原子数为0.3NA | B. | 20g D2O所含的中子数为10NA | ||
| C. | 16g CH4中含C-H键数目为NA | D. | 1 mol 氦气含有的原子数为2NA |
分析 A、气体所处的状态不明确;
B、重水的摩尔质量为20/mol,求出重水的物质的量,然后根据1mol重水中含10mol中子来计算;
C、求出甲烷的物质的量,然后根据1mol甲烷中含4molC-H键来计算;
D、氦气是单原子分子.
解答 解:A、气体所处的状态不明确,故无法计算二氧化碳的物质的量,故A错误;
B、重水的摩尔质量为20/mol,故20g重水的物质的量为1mol,而1mol重水中含10mol中子,即10NA个,故B正确;
C、16g甲烷的物质的量为1mol,而1mol甲烷中含4molC-H键,即4NA个,故C错误;
D、氦气是单原子分子,故1mol氦气中含1mol氦原子,即NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目;W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 根据已有知识判定下列说法中不正确的是( )
根据已有知识判定下列说法中不正确的是( )| A. | 可使酸性高锰酸钾溶液褪色 | B. | 可跟银氨溶液反应生成银镜 | ||
| C. | 可使溴水褪色 | D. | 催化加氢后最终产物是C10H20O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
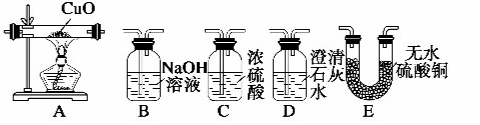
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
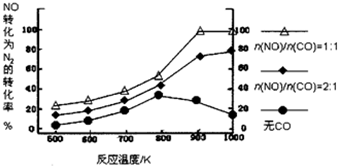
| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
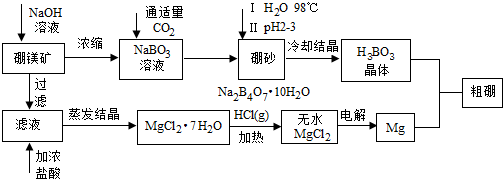
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O22-与S2-具有相同的质子数和电子数 | |
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 | |
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com