
| A. | c(Na+):c(SO32-)<2:1 | |
| B. | c(Na+)=2 c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=2 c(SO32-)+2 c(HSO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(SO32-) 与c(Na+) 均增大 |
分析 A、0.1mol/L Na2SO3溶液中亚硫酸根离子水解;
B、溶液中存在的物料守恒,n(Na)=2n(S),钠元素物质的量和所有硫元素物质的量总和相同;
C、溶液中的电荷守恒,阴阳离子所带电荷总数相同;
D、加入氢氧化钠固体,抑制水解,溶液中氢氧根离子浓度增大.
解答 解:A、0.1mol/L Na2SO3溶液中亚硫酸根离子水解,c(Na+):c(SO32-)>2:1,故A错误;
B、溶液中存在的物料守恒,n(Na)=n(S),钠元素物质的量和所有硫元素物质的量总和相同,c(Na+)=2 c(SO32-)+2c(HSO3-)+2c(H2SO3),故B错误;
C、溶液中的电荷守恒,阴阳离子所带电荷总数相同,c(Na+)+c(H+)=2 c(SO32-)+c(HSO3-)+c(OH-),故C错误;
D、加入氢氧化钠固体,溶液中氢氧根离子浓度增大,且抑制亚硫酸根离子的水解,SO32-+H2O?HSO3-+OH-的水解平衡逆向进行,c(SO32-) 与c(Na+) 均增大,故D正确;
故选D.
点评 本题考查了盐类水解的分析、电解质溶液中物料守恒、电荷守恒、影响水解平衡的因素等知识点,掌握基础是解题关键,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属阳离子 | B. | 离子化合物中可能含有共价键 | ||
| C. | 共价化合物中可能含有离子键 | D. | 共价键只存在于共价化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱:Cl2<S | B. | 金属性强弱:K<Na | ||
| C. | 酸性强弱:H3PO4<H2SO4 | D. | 碱性强弱:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
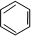 ;一种常见的烃的含氧衍生物:
;一种常见的烃的含氧衍生物: .
. .
.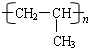 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| n(N2O5)/mol | 10.0 | 7.04 | 4.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )
室温下向10ml 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示,下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(OH-) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 还原剂得电子总数与氧化剂失电子总数相等 | |
| C. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| D. | 非金属元素的最高价氧化物的水化物不一定都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 都不能证明 | C. | ①⑤能证明 | D. | 只有⑤能证明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com