
分析 将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,
以此解答该题.
解答 解:将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,
(1)此时A的浓度c(A)=$\frac{(3-1.5)mol}{2L}$=0.75mol/L,反应开始前容器中的A、B的物质的量n(A)=n(B)=3mol,故答案为:0.75;3;
(2)v(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),故答案为:0.05;
(3)C的平均反应速率为0.1mol/(L•min),则$\frac{\frac{0.5xmol}{2L}}{5min}$=0.1mol/(L•min),则x=2,故答案为:2.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
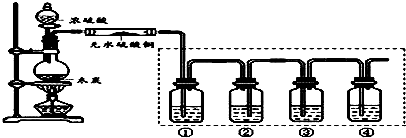
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
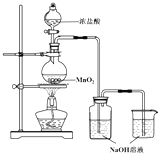 某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
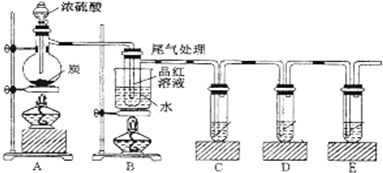
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
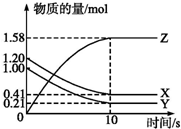 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 因正反应吸热,所以升高温度正反应速率加快,逆反应速率减慢 | |
| C. | 当v(X)=v(Z)时,反应达到平衡 | |
| D. | 混合气体的密度不变时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用该反应进行人工固氮 | |
| B. | 将3mol N2(g)和3mol H2(g)混合,在高温、高压和催化条件下充分反应,放出热量92.22kJ | |
| C. | 因为反应需要加热,所以反应放出热量 | |
| D. | 其他条件相同时,采用更高效的正催化剂,既能提高反应速率,又能增大反应放热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com