
下列根据反应原理设计的应用,不正确的是
A.CO32—+H2O HCO3—+OH-;用热的纯碱溶液清洗油污
HCO3—+OH-;用热的纯碱溶液清洗油污
B.Al3++3H2O Al(OH)3(胶体)+3H+;明矾净水
Al(OH)3(胶体)+3H+;明矾净水
C.TiCl4+(x+2)H2O(过量)  TiO2·xH2O↓+4HCl;制备TiO2纳米粉
TiO2·xH2O↓+4HCl;制备TiO2纳米粉
D.SiCl2+H2O Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH
Sn(OH)Cl↓+HCl;配制氯化亚锡溶液时加入NaOH
科目:高中化学 来源:2016届黑龙江双鸭山第一中学高三上学期期中测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法不正确的是
A.原子半径大小顺序:r(Z)>r(W)>r(X) >r(Y)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的最高价氧化物对应水化物的酸性强
D.Y的简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
0.6mol/L的Fe2(SO4)3和1.2mol/L的CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
A.0.16 mol B.0.22mol C.0.30mol D.0.48mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高一上学期期中测试化学试卷(解析版) 题型:选择题
与标况下 11.2L的CO2所含氧原子数相等的水的质量为
A. 44g B. 22g C. 18g D. 9g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:实验题
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:__________________________(用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 (填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为____ mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C= mol/L。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月阶段性测试化学试卷(解析版) 题型:选择题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
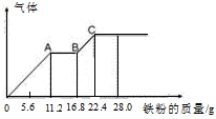
A.混合酸液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月阶段性测试化学试卷(解析版) 题型:选择题
关于化学键的叙述正确的是
A.离子化合物中只存在离子键
B.非金属元素组成的化合物中可能存在离子键
C.由不同种元素组成的多原子分子里,一定只存在极性共价键
D.含金属元素的化合物中一定存在离子键
查看答案和解析>>
科目:高中化学 来源:2016届湖北省老河口市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3- CaCO3↓+H2O
B.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O SO32-+2HClO
D.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2 3Fe3++6Cl-+2Br2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高二上学期期中测试化学试卷(解析版) 题型:选择题
下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是
A.化学反应速率理论可指导怎样提高原料的转化率
B.化学反应速率理论可指导怎样在一定时间内快出产品
C.化学平衡理论可指导怎样使用有限原料多出产品
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com