
| A. | 酒精和水:分液 | |
| B. | 淀粉溶液(胶体)中混有氯化钠:用半透膜进行渗析 | |
| C. | 汽油和柴油:分馏 | |
| D. | 三氯甲烷和水:分液 |
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:实验题
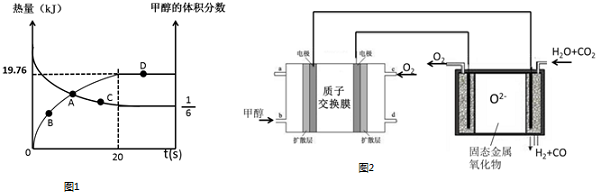
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
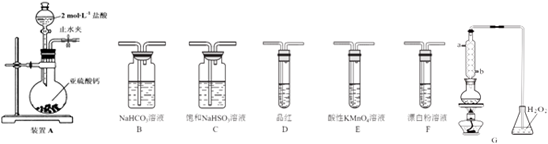
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
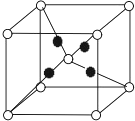 A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.
A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
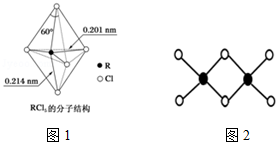 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B生成速率与C分解速率相等 | |
| B. | 容器内气体的平均分子量不再变化 | |
| C. | 单位时间生成n mol A,同时生成3n mol B | |
| D. | 容器内气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢的五种同位素 | B. | 五种氢元素 | ||
| C. | 都不带电荷的粒子 | D. | 氢元素的五种不同粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
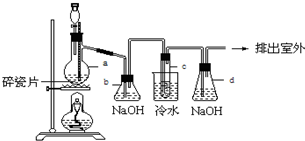
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com