
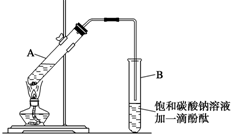
 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
分析 (1)从浓硫酸溶于水放热和加热时试管内液体的体积不超过试管容积的1/3”分析,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
(2)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,进行解答;
(3)有机反应副反应多,且乙酸和乙醇易挥发;
(4)根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;
(5)根据乙酸乙酯的性质,分离出乙酸乙酯层后,用饱和食盐水除去饱和的碳酸钠以及少量的乙醇.
解答 解:(1)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的1/3”,加入药品的顺序为在一个30mL大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸和3mL乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL),
故答案为:在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀;
(2)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,导管不能插入到Na2CO3溶液中,防止倒吸回流现象的发生,
故答案为:防止倒吸;
(3)有机反应副反应多,且乙酸和乙醇的沸点低、易挥发,如果加热温度过高易引起更多的副反应和导致乙酸和乙醇的大量挥发,
故答案为:反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应;
(4)碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,振荡时乙酸和碳酸钠反应而使溶液红色变浅,
故答案为:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)分离出乙酸乙酯层后,乙酸乙酯中含有极少量的乙醇和饱和碳酸钠,用乙醇洗涤引入新的杂质,用饱和食盐水能和乙醇饱和碳酸钠互溶,且与乙酸乙酯分层,
用碳酸钠溶液,碳酸钠杂质无法去除,用NaOH溶液乙酸乙酯在碱性条件下发生水解反应,产品损耗,所以选择饱和食盐水,
故选B.
点评 本题主要考查了乙酸乙酯的制备,掌握乙酸乙酯的制备原理,注意分离出乙酸乙酯层后产品的洗涤为易错点,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
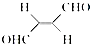 ,下列叙述正确的有AD.
,下列叙述正确的有AD. 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
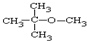 .
.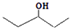 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.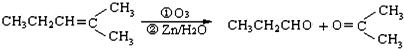
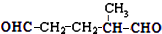 ,则烃A的结构可表示为
,则烃A的结构可表示为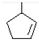 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
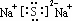 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “海市蜃楼”是一种与光学和胶体性质相关的自然现象 | |
| B. | 铁制管道涂铝粉可防锈蚀 | |
| C. | 锂可用于制造质量轻、容电量大的可充电电池 | |
| D. | 焊锡中铅的作用是提高熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
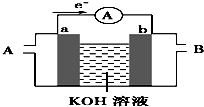 (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
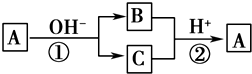 A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )| A. | 反应①和②互为可逆反应 | B. | X元素可能为铝 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com