
����Ŀ�������仯�����ڹ��õķ�չ��������Ҫ���ã�
��1�����ڳ�ʪ�Ŀ����������绯ѧ��ʴ��ijͬѧ��NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ����������a���ѱ���ʴ���䰵����Һ�������γ���ɫ�����b������ͼ1��ʾ��Һ�α�Ե�ǩ��������������������������缫��ӦʽΪ �� 
��2�����ѺϽ���һ�ֳ��õIJ���ֲ��ϣ�ijͬѧ��̽���úϽ������ʱ��������TiO2+��Fe3+��Һ�м�����м����Һ����ɫ���ù����з����ķ�Ӧ�У�
��2TiO2+����ɫ��+Fe+4H+�T2Ti3+����ɫ��+Fe2++2H2O
��Ti3+����ɫ��+Fe3++H2O�TTiO2+����ɫ��+Fe2++2H+
�� ��
��3���������ƣ�Na2FeO4����һ��������ˮ��������
��FeO42����ˮ��Һ�еĴ�����̬��ͼ2��ʾ���������ʾ��������̬�ķ����ֲ�������˵������ȷ����������ĸ��ţ���
A��������Һ�������α仯����Ԫ�ض���4�ִ�����̬
B����pH=10��������Һ�м�������pH=2��HFeO4���ķֲ�����������
C����pH=6��������Һ�м�KOH��Һ��������Ӧ�����ӷ���ʽΪ��HFeO4��+OH���TFeO42��+H2O
�ڴӻ��������ĽǶȿ����Ʊ��������εĽϺ÷���Ϊ��ⷨ������Ƭ��������NaOH��ҺΪ�������Һ������Ʊ��������ƣ������Ч�ʿɴﵽ40%��д�������ĵ缫��Ӧʽ
�� ��˿���缫�Ǹ�������������ϣ���ͬ�����£��ɽ�����Ч�������70%���ϣ�ԭ���� ��
��ά�ֵ���ǿ��Ϊ5.0A�����20min�������Ͽ�����Na2FeO4g������֪��F=96500C/mol���𰸱�����λ��Ч���֣�
���𰸡�
��1��O2+2H2O+4e��=4OH��
��2��2Fe3++Fe=3Fe2+
��3��AB��Fe��6e��+8OH��=FeO42��+4H2O��Fe��6e��+8OH��=FeO42��+4H2O����˿���ĽӴ��������1.7
���������⣺��1.���������������·���������ʴ������������̼����������������ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ�������������ӣ����������Ӻ��������ӷ�Ӧ�����������������������������ȶ������������������������Ա�Ե�������������ϵ缫��ӦʽΪ��O2+2H2O+4e��=4OH�� �� ���Դ��ǣ�������O2+2H2O+4e��=4OH����
��2.�����������ӷ���������ԭ��Ӧ�����������ӣ����ӷ�Ӧ����ʽΪ��2Fe3++Fe=3 Fe2+ �� ���Դ��ǣ�2Fe3++Fe=3Fe2+��
��3.����A������ͼ��֪��������Һ�������α仯�����������£�����������Ӳ����ڣ��ʴ���B����pH=10��������Һ�м�������pH=2��HFeO4���ķֲ�������������С���ʴ���C����pH=6��������Һ�м�KOH��Һ��������Ӧ�����ӷ���ʽΪ��HFeO4��+OH���TFeO42��+H2O������ȷ����ѡAB��
��������ʧȥ���ӣ����ɸ������Σ��缫��ӦʽΪ��Fe��6e��+8OH��=FeO42��+4H2O����˿���Ӵ�������ӿ췴Ӧ���ʣ����Ե���Ч�������70%���ϣ�ά�ֵ���ǿ��Ϊ5.0A�����20min��ͨ������ΪQ=It=5.0A��20��60s=6000C��F=96500C/mol���������ʵ���= ![]() =0.062mol����ѧ����ʽ�����֪����ת��6mol����1molNa2FeO4 �� �����ת��0.062mol����Na2FeO4���ʵ���ҲΪ
=0.062mol����ѧ����ʽ�����֪����ת��6mol����1molNa2FeO4 �� �����ת��0.062mol����Na2FeO4���ʵ���ҲΪ ![]() ������=
������= ![]() ��166g/mol��1.7g�������Ͽ�����Na2FeO4����Ϊ1.7g�����Դ��ǣ�Fe��6e��+8OH��=FeO42��+4H2O����˿���ĽӴ��������1.7g��
��166g/mol��1.7g�������Ͽ�����Na2FeO4����Ϊ1.7g�����Դ��ǣ�Fe��6e��+8OH��=FeO42��+4H2O����˿���ĽӴ��������1.7g��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڿ����г�ʱ����ò��ױ��ʵ���
A��Na B��NaOH C��NaCl D��Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ���ۺϴ���SO2�����Ĺ������̣���ÿ����Ӧ����ȫ������˵����ȷ���ǣ��跴Ӧ��������Һ��������䣩�� �� 
A.��ҺB�з����ķ�ӦΪ��2SO2+O2��2SO3
B.�ɷ�Ӧ���̿���֪�����ԣ�O2��Fe3+��SO42��
C.��Һ��pH��A��B��C
D.A��Һ��C��Һ��Fe3+Ũ�ȱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��40��ʱ���ڰ���ˮ��ϵ�в���ͨ��CO2 �� �������ӵı仯������ͼ��ʾ������˵������ȷ���ǣ� �� 
A.��pH=9.0ʱ��c��NH4+����c��HCO3������c��NH2COO������c��CO32����
B.��ͬpH����Һ�д��ڹ�ϵ��c��NH4+��+c��H+��=2c��CO32����+c��HCO3����+c��NH2COO����+c��OH����
C.����CO2��ͨ�룬 ![]() ��������
��������
D.����ҺpH���Ͻ��͵Ĺ����У��к�NH2COO�����м��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ�Ⱦ�Ϊ1molL��1������4����Һ��
��H2SO4��Һ��NaHCO3��Һ��NH4Cl��Һ��NaOH��Һ
��1����4����ҺpH�ɴ�С������˳����������ţ���������ˮ�������H+Ũ����С����������ţ���
��2�����и�����Ũ���ɴ�С��˳���� �� ���¶��¢���NaHCO3��ˮ��ƽ�ⳣ��Kh=molL��1 �� ����֪̼��ĵ��볣��K1=4��10��7 �� K2=5.6��10��11��
��3�����¶��������ͨ��������������ʱ ![]() ��ֵ�����������С�����䡱����
��ֵ�����������С�����䡱����
��4�������ۺܻ͢�Ϻ���Һǡ�ó����ԣ�����ǰ�۵�����ܵ����������ڡ�����С�ڡ����ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ǵĽ���ϢϢ��أ�Ŀǰ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2��CO������3���е���Ⱦ�
��1��һ���¶��£���̶����Ϊ2L���ܱ������г���SO2��NO2��1mol��������ӦSO2��g��+NO2��g��SO3��g��+NO��g�������������Ӧ5minĩ����ƽ�⣬��ʱ������NO��NO2�������Ϊ3��1�������ʱ����SO2�ķ�Ӧ���ʦԣ�SO2��= �� �˷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K= ��
��2���״�������Ϊ��Ҫ���л�ȼ�ϣ�ͨ������CO��H2�ϳɼ״����䷴Ӧ�Ļ�ѧ����ʽΪCO��g��+2H2��g��CH3OH��g��������һ�ݻ��ɱ���ܱ������У�����10mol CO��20mol H2���ںϳɼ״���CO��ƽ��ת���ʣ��������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ��ʾ��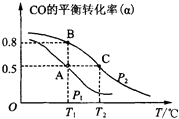
�������ϳɼ״��ķ�ӦΪ��Ӧ������ȡ������ȡ�����
��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ �� A��B�����Ӧ��ѹǿ��С��ϵ��PAPB������ڡ�����С�ڡ����ڡ�����
�������ﵽƽ��״̬Aʱ���ɵļ״����ڹ��ɼ״�һ����ȼ�ϵ�أ��������ҺΪKOHŨ��Һ����õ�ع���ʱ�����ĵ缫��ӦʽΪ �� ������ͨ�����·�ĵ������Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Һ��ε���Fe(OH)3�����ڡ���ʼʱ���������������μ�ʱ�������ܽ⣬����Һ��
A. 2 mol��L-1 H2SO4��Һ B. 2 mol��L-1 NaOH��Һ
C. 2 mol��L-1 MgSO4��Һ D. �Ҵ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����ͼ(1)��A��B��������ֱ��ռ������ֻ������õ��������塣ѹǿ���䣬�����м������[��ͼ(2)]�������������������ռ������������������һ�������������仯���Է����̡����ڴ˹��̵�����˵������ȷ����( )

����������Է����
A���˹���Ϊ���ҳ̶�С������ҳ̶ȴ�ķ�����еı仯���̣���������Ĺ���
B���˹���Ϊ�Է����̣�����û�����������ջ�ų�
C���˹��̴����������Ҷ�����
D���˹������Է������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�1,2��������ķ�Ӧԭ�����£�
CH3CH2OH![]() CH2===CH2����H2O
CH2===CH2����H2O
CH2===CH2��Br2��BrCH2CH2Br
���ܴ��ڵĸ���Ӧ���Ҵ���Ũ���������140��ʱ��ˮ�������ѡ�
������������������Ҵ���Ӧ�Ʊ�1,2���������װ����ͼ��ʾ��

�Ҵ� | 1,2�������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g��cm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
��ش��������⣺
(1)�ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶����ߵ�170�����ң�����Ҫ��Ŀ����________(����ţ���ͬ)��
a��������Ӧ
b���ӿ췴Ӧ�ٶ�
c����ֹ�Ҵ��ӷ�
d�����ٸ�������������
(2)��װ��C��Ӧ����___________����Ŀ�������շ�Ӧ�п������ɵ��������塣
a��ˮ b��Ũ����
c������������Һ d������̼��������Һ
(3)�жϸ��Ʊ���Ӧ�Ѿ��������������____________________��
(4)��1,2��������ֲ�Ʒ���ڷ�Һ©���У���ˮ���ã�����Ӧ��________(��ϡ����¡�)�㡣
(5)��������������δ��Ӧ��Br2�������________ϴ�ӳ�ȥ��
a��ˮ b������������Һ
c���⻯����Һ d���Ҵ�
(6)�����������������������ѣ�����________�ķ�����ȥ��
(7)��Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ����________________�����ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ����____________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com