
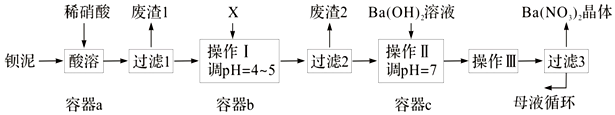
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡.
(1)Ba(FeO2)2与中钡元素和铁元素的化合价分析反应产物,然后写出方程式;
(2)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(3)根据三价铁离子和二价铁离子完全沉淀时的PH分析;
(4)根据从溶液中提取溶质的方法分析;
(5)根据母液中的成分判断;
(6)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:(1)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,故答案为:B;
(3)已知Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7,流程中调节PH为4~5,所以三价铁离子会完全转化为沉淀Fe(OH)3,故答案为:Fe(OH)3;
(4)从溶液中提取溶质的方法为:蒸发浓缩、冷却结晶,然后过滤,所以操作Ⅲ为蒸发浓缩、冷却结晶;故答案为:蒸发浓缩、冷却结晶;
(5)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,故答案为:c;
(6)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则 $\frac{261}{x}$=$\frac{233}{mg}$,解得x=$\frac{261m}{233}$,所以该Ba(NO3)2的纯度为 $\frac{261m}{\frac{233}{w}}$×100%=$\frac{261m}{233w}$×100%,
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 化合反应大多数是放热反应,分解反应全都是吸热反应 | |
| B. | C(金刚石,s)+O2(g)=CO2(g)的反应热等于1molO2的键能与1molCO2中键能的差 | |
| C. | 热化学方程式中,反应条件可以不写,而且各物质前的化学计量数可以是分数 | |
| D. | 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②⑤ | C. | ②③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用手接触药品 | |
| B. | 用一只酒精灯点燃另一只酒精灯 | |
| C. | 实验后,剩余的药品不能放回原瓶,也不能随便丢弃 | |
| D. | 将带有溶液的胶头滴管平放在实验台上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  :2-甲基丙烯 :2-甲基丙烯 | B. | (CH3)2CHCH(CH3)2:1,4-而甲基丁烷 | ||
| C. | 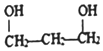 :1,3-二丙醇 :1,3-二丙醇 | D. | 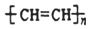 :聚乙烯 :聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 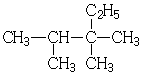 2,3-二甲基-3-乙基丁烷 | B. | 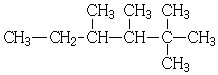 2,2,3,4-四甲基己烷 | ||
| C. |  对二甲苯 | D. |  2,4,4-三甲基戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
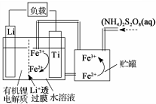
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com