
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023 | |
| D. | 标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
分析 A.常温常压下Vm≠22.4L/mol;
B.由CO2和O2组成的混合物,分子中都含有2个氧原子,NA个分子物质的量为1mol;
C.过氧化钠中氧元素的化合价为-1价,根据n=$\frac{VL}{22.4L/mol}$计算出氧气的物质的量,再计算出转移的电子数;
D.标况下三氧化硫为固体.
解答 解:A.常温常压下Vm≠22.4L/mol(大于22.4),氯气不足,转移的电子数小于3NA,故A错误;
B.由CO2和O2组成的混合物,分子中都含有2个氧原子,NA个分子物质的量为1mol,由CO2和O2组成的混合物中共有个NA分子,其中的氧原子数为2NA,故B正确;
C.标况下1.12L氧气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,过氧化钠与水反应生成0.05mol氧气转移了0.1mol电子,反应中转移的电子数为6.02×1022,故C错误;
D.标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其体积,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2既是氧化剂,又是还原剂 | |
| B. | O2是还原产物,Mn2+是氧化产物 | |
| C. | 通常用浓盐酸酸化高锰酸钾溶液 | |
| D. | 标准状况下,产生22.4 L O2时反应转移2 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HBr | B. | 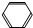 -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
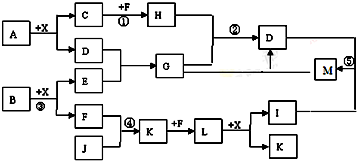
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
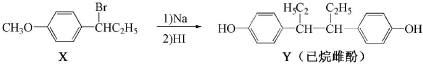
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 596.6 kJ•mol-1,则2 mol C2H2(g)完全燃烧生成气态水时放出的热量大于2 596.6 kJ | |
| B. | 1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,则其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1; ②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1. 则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
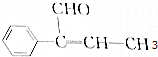 ,下列关于A的叙述中错误的是( )
,下列关于A的叙述中错误的是( )| A. | 在加热和催化剂作用下,能被氢气还原 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在一定条件下能与溴发生取代反应 | |
| D. | 不能与氢溴酸发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com