
【题目】已知4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=﹣1 025kJmol﹣1是一个可逆反应.若反应物起始物质的量相同,则如图中关于该反应不正确的是( )
A.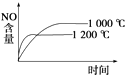
B.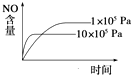
C.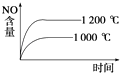
D.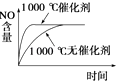
【答案】C
【解析】解:A.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故A正确;
B.正反应是气体体积增大的反应,增大压强,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象与实际相符合,故B正确;
C.正反应是放热反应,升高温度,先到达平衡,平衡向逆反应方向移动,平衡时NO的含量减少,图象中达到平衡的时间与实际不相符合,故C错误;
D.催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡的时间,故D正确.
故选C.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H0(填“>”、“=”或“<”);
②某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 . a.升温b.加入催化剂c.增加CO的浓度
d.加入H2加压e.加入惰性气体加压f.分离出甲醇
(4)一定条件下,CO与H2在催化剂的作用下生成5molCH3OH的能量变化为454kJ.在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | 1molCH3OH | 2molCH3OH | |
平 | CH3OH的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强(Pa) | p1 | p2 | p3 | |
反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是 .
A.2c1>c3
B.a+b<90.8
C.2p2<p3
D.α1+α3<1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在第3周期中,置换酸中氢的能力最强的元素的元素符号为______,化学性质最稳定的元素符号是________,最高价氧化物的水化物的酸性最强的化合物的化学式是_______,碱性最强的化合物的化学式是___________,显两性的氢氧化物的化学式是____________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为_______________________________、_________________________________,原子半径最大的金属元素的名称是____________________,离子半径最小的离子结构示意图是 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 25℃时,pH均为1的盐酸和醋酸加水稀释1000倍,所得溶液的pH:醋酸>盐酸
B. 等体积、等物质的量浓度的NH4HSO4和KOH溶液混合:c(K+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
C. 25℃时,pH=12的氨水和pH=2的盐酸等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. 浓度均为0.1 molL-1的HClO溶液和NaClO溶液等体积混合,溶液中有下列关系:c(HC1O)+2c(H+)=c(C1O-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com