
| A. | 一定条件下能发生加聚反应 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 该有机物能发生加成反应但不能发生催化氧化生成醛 | |
| D. | 1mol该有机物能与足量的金属钠反应放出0.5mol H2 |
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
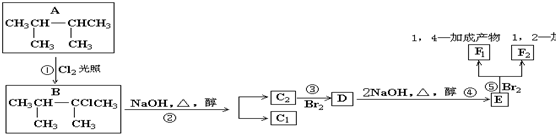
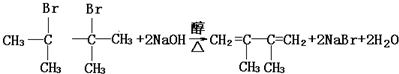 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个化学过程的示意图.
如图是一个化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾与水的反应比钠与水的反应更剧烈 | |
| B. | 溴单质与水的反应比氯单质与水的反应更剧烈 | |
| C. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| D. | 碱金属元素中,锂原子失去最外层电子的能力最弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.4g CO2中含有的原子数为0.3NA | |
| B. | 标准状况下,22.4L甲烷中含有的C-H键数为4NA | |
| C. | 5.6g 铁粉与硝酸反应失去的电子数可能为0.25NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com