
分析 (1)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0;
(2)只有P元素的化合价变化,由0升高为+5价,由0降低为-3价;
(3)Cl元素的化合价由+1价降低为-1价,Fe元素的化合价由+3价升高为+6价,结合电子、原子、电荷守恒来解答.
解答 解:(1)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,由电子、原子、电荷守恒可知反应为2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O,
故答案为:2;16;10;2;5;8;
(2)只有P元素的化合价变化,由0升高为+5价,由0降低为-3价,由电子、原子、电荷守恒可知反应为2P4+9KOH+3H2O═3K3PO4+5PH3,
故答案为:2;9;3;3;5;
(3)Cl元素的化合价由+1价降低为-1价,Fe元素的化合价由+3价升高为+6价,由电子、原子、电荷守恒可知配平后离子反应为3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,故答案为:3;2;4OH-;3;2;5.
点评 本题考查氧化还原反应的配平,为高频考点,把握反应中元素的化合价变化、电子及电荷守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊A |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 35 | 数据模糊B |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊C |
| 7 | 0.10 | 丝 | 1.0 | 50 | 数据模糊D | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 未测数据 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol•L-1的溶液 |
| D | 烧杯、分液漏斗 | 用CCl4分离碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放出Y kJ | B. | 放出(5X-0.5Y) kJ | C. | 放出(10X-Y) kJ | D. | 吸收(10X-Y) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中醋酸根浓度与醋酸分了浓度比值变大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
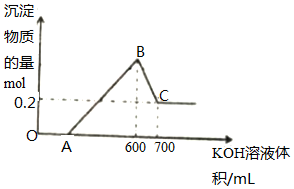 将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com