
| A. | 电解熔融氯化钠可制金属钠 | |
| B. | 钠与氧气反应的产物与反应条件无关 | |
| C. | ClO2可用于自来水的消毒 | |
| D. | “氯碱工业”是指电解食盐水制取氯气等产品的工业 |
分析 A.电解熔融氯化钠,阴极上钠离子得到电子;
B.钠与氧气常温下反应生成氧化钠,加热下反应生成过氧化钠;
C.ClO2具有强氧化性;
D.惰性电极电解食盐水生成NaOH、氢气、氯气.
解答 解:A.电解熔融氯化钠,阴极上钠离子得到电子,则电解熔融氯化钠可制金属钠,故A正确;
B.钠与氧气常温下反应生成氧化钠,加热下反应生成过氧化钠,则产物与反应条件有关,故B错误;
C.ClO2具有强氧化性,则可用于自来水的消毒,故C正确;
D.惰性电极电解食盐水生成NaOH、氢气、氯气,为“氯碱工业”,可制备基本化工原料,故D正确;
故选B.
点评 本题考查电解原理及应用,为高频考点,把握物质的性质、电解原理、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
| A. | 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④ | |
| B. | 分别加水稀释10倍,四种溶液的pH:①>②>④>③ | |
| C. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va:Vb=9:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
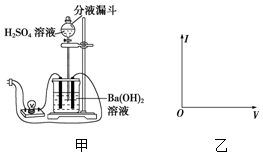 使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:
使用中学常用的实验器材,设计一个实验观察Ba(OH)2与H2SO4在溶液中的反应导电性的变化,并回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含有等物质的量的Ba(OH)2、KOH的混合溶液中通入CO2,与CO2反应的物质依次是:KOH、Ba(OH)2、BaCO3 | |
| B. | 向含有等物质的量的Fe2+、Ag+、Cu2+的混合溶液中加入Zn,与Zn反应的离子依次是:Ag+、Cu2+、Fe2+ | |
| C. | 向含有等物质的量的AlO2-、OH-、CO32-的混合溶液中滴加盐酸,与盐酸反应的物质依次是:AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气,与氯气反应的离子依次是:I-、Br-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 在101Kpa时,2g H2完全燃烧生成液态水,放出285.8 KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-53.7 kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
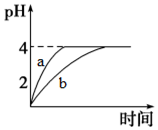 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
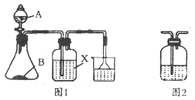 某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:
某化学兴趣小组探究二氧化硫和氯气二者的制法和性质,做下列有关实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4是还原剂 | B. | HC1是氧化剂 | ||
| C. | HC1中的氯元素得到电子 | D. | KMnO4中的Mn元素被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com