

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
沉淀完全时PH | 3.2 | 5.4 | 12.4 |
| ||


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:

| 实验小组 | 称取CuSO4的质量(g) | 装置C增加的质量(g) | 量筒中水的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B、使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C、采用循环操作,能提高NH3的平衡浓度 |
| D、采用循环操作,能加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
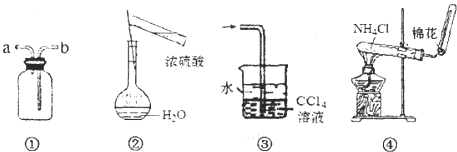
| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、M:Na X:O2 |
| B、M:HNO3 X:Fe |
| C、M:Al X:NaOH |
| D、M:NH3 X:O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com