
 .
.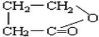 .
. .
.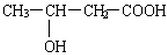 、
、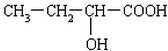 、
、 、
、 .
. 分析 ①标况下3.92L氧气的物质的量为:$\frac{3.92L}{22.4L/mol}$=0.175mol,氧气的质量为:32g/mol×0.175mol=5.6g,2.8L二氧化碳的物质的量为:$\frac{2.8L}{22.4L/mol}$=0.125mol,二氧化碳的质量为:44g/mol×0.125mol=5.5g,根据质量守恒,生成水的质量为:2.6g+5.6g-5.5g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,根据O原子守恒,原有机物分子中含有O原子的物质的量为:0.15mol+0.125mol×2-0.175mol×2=0.05mol,所以A分子中C、H、O原子的数目之比为:0.175mol:(0.15mol×2):0.05mol=5:12:2,A的最简式为C5H12O2,由于该最简式中含有H原子数达到饱和,则A的最简式即为其分子式,
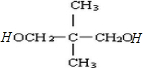
②A不能发生消去反应,但能与C发生缩聚生成聚酯D,则A分子中含有2个羟基,且与羟基相邻C上没有H,则A的结构简式为: ,
,
A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个,则B中含有4个C、C中含有3个C,则B中比A多1个O、少4个H原子,故B的分子式为:C4H8O3;C比A多2个O、少8个H,C的分子式为:C3H4O4;结合C能够发生缩聚反应可知C的结构简式为:HOOCCH2COOH,
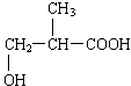
③B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E,则B分子中含有羧基和羟基,其结构简式为:CH2(OH)CH2CH2COOH,据此进行解答.
解答 解:①标况下3.92L氧气的物质的量为:$\frac{3.92L}{22.4L/mol}$=0.175mol,氧气的质量为:32g/mol×0.175mol=5.6g,2.8L二氧化碳的物质的量为:$\frac{2.8L}{22.4L/mol}$=0.125mol,二氧化碳的质量为:44g/mol×0.125mol=5.5g,根据质量守恒,生成水的质量为:2.6g+5.6g-5.5g=2.7g,水的物质的量为:$\frac{2.7g}{18g/mol}$=0.15mol,根据O原子守恒,原有机物分子中含有O原子的物质的量为:0.15mol+0.125mol×2-0.175mol×2=0.05mol,所以A分子中C、H、O原子的数目之比为:0.175mol:(0.15mol×2):0.05mol=5:12:2,A的最简式为C5H12O2,由于该最简式中含有H原子数达到饱和,则A的最简式即为其分子式,
②A不能发生消去反应,但能与C发生缩聚生成聚酯D,则A分子中含有2个羟基,且与羟基相邻C上没有H,则A的结构简式为: ;
;
A、B、C均是由碳、氢、氧三种元素组成的有机物,它们的相对分子质量相等,但碳原子数依次减少一个,则B中含有4个C、C中含有3个C,则B中比A多1个O、少4个H原子,故B的分子式为:C4H8O3;C比A多2个O、少8个H,C的分子式为:C3H4O4;结合C能够发生缩聚反应可知C的结构简式为:HOOCCH2COOH;
③B的溶液显酸性,分子中无甲基,一定条件下分子内部可脱水生成环状物E,则B分子中含有羧基和羟基,其结构简式为:CH2(OH)CH2CH2COOH,
(1)根据分析可知,A的结构简式为: ,
,
故答案为: ;
;
(2)B的结构简式为CH2(OH)CH2CH2COOH,其分子中含有羟基和羧基,能够发生缩聚反应,生成产物的结构简式为: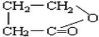 ,
,
故答案为: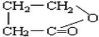 ;
;
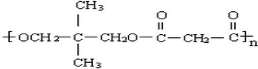
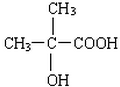
(3)A的结构简式为 ,C为HOOCCH2COOH,二者分子分别含有两个羟基、两个羧基,可形成缩聚物D,则D的结构简式为:
,C为HOOCCH2COOH,二者分子分别含有两个羟基、两个羧基,可形成缩聚物D,则D的结构简式为: ,
,
故答案为: ;
;
(4)B的结构简式为CH2(OH)CH2CH2COOH,B′与B互为同分异构体,且是同类物质,则B′分子中含有1个羧基和1个羟基,其可能的结构简式有: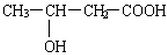 、
、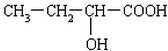 、
、 、
、 ,
,
故答案为: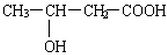 、
、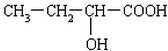 、
、 、
、 .
.
点评 本题考查了有机推断,题目难度较大,根据题中信息正确推断A、B、C的结构简式为解答关键,注意掌握常见有机物结构与性质,明确同分异构体的概念及书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②⑤ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10 mL该硫酸于烧杯中,再加18.4 mL的水,可配得49%的硫酸 | |
| C. | 配制200 mL 4.6 mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量 氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
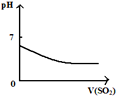 | 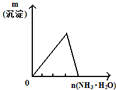 | 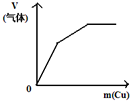 | 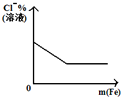 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
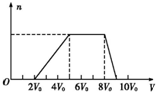 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28.0L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | x mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com