
| A. | 苯和水 | B. | 硝酸钾和氯化钠 | ||
| C. | 食盐水和泥沙 | D. | 乙酸丁酯和1-丁醇 |
科目:高中化学 来源: 题型:解答题
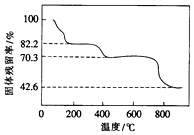 硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.
硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂.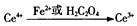
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水清除试管壁附着的银镜 | |
| B. | 用氢氧化钠溶液清洗沾在皮肤上的苯酚 | |
| C. | 用食醋清除暖瓶水垢(主要成分碳酸钙) | |
| D. | 用碳酸钠溶液清除钢铁制品表面的铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)═10-7mol•L-l | |
| B. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(C1-)+c(H+)═c(NH4+)+c(OH-) | |
| C. | 常温下0.1 mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10 -10 mol•L-l | |
| D. | 常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 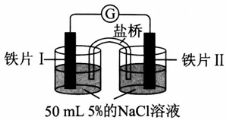 | 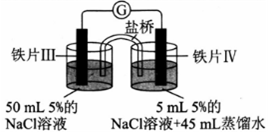 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | 加热铁片I所在烧杯,电流表指针会发生偏转 | |
| B. | 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极 | |
| C. | 铁片I、Ⅲ的腐蚀速率相等 | |
| D. | “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
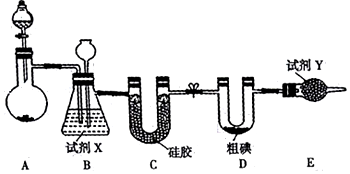
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2H2(g)+O2(g)═2H2O(l) 在室温下可自发进行,则该反应的△H<0 | |
| B. | 常温常压下,7.8gNa2O2与水完全反应,产生1.12L气体 | |
| C. | 煤的干馏是物理变化,石油的裂化是化学变化 | |
| D. | 气体分子总数不再改变时,反应H2(g)+I2(g)?2HI(g))达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用裂化汽油萃取溴水中的溴,将有机层从分液漏斗上口倒出 | |
| B. | 制备氢氧化亚铁时将装有NaOH溶液的胶头滴管插入液面深处并挤压 | |
| C. | 向蔗糖水解后的产物中加入银氨溶液,加热,检验蔗糖是否水解 | |
| D. | 将饱和FeCl3溶液滴入NaOH溶液中制备Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com