

���� ��1��CO2��NH3�ϳ�CO��NH2��2������Ԫ���غ��֪��ͬʱ����H2O���ɣ���ƽ��д����ʽ��
��2������CO2��ת������ʱ��仯ͼ����֪��A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У���B�㴦��ƽ��״̬��
����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ4a����ͼ��֪��CO2��ת����Ϊ60%����ת���Ķ�����̼Ϊ0.6a�����ݷ���ʽ����ת����NH3�����ʵ������ٸ���ת���ʶ�����㣻
��a��������Ӧ��2NH3��g��+CO2��g�� CO��NH2��2 ��s��+H2O��g�����淴Ӧ����ѹǿ��С�������е�ѹǿ����˵������ƽ��״̬��
CO��NH2��2 ��s��+H2O��g�����淴Ӧ����ѹǿ��С�������е�ѹǿ����˵������ƽ��״̬��
b������2molH-O����ͬʱ����6molN-Hʱ����Ӧ����ƽ�⣻
c��ƽ��ʱ������̼��ˮ��Ũ�ȹ�ϵ�������̼ת�����йأ�
d�����淴Ӧ����ƽ��ʱ����Ӧ���������Ũ�Ȳ��䣻
��3������ͼ��֪�����ҵ缫����ΪCl2������������Ӧ����AΪ��Դ�����������ҵ�����H2��������ԭ��Ӧ��
����ͼ��֪�������������������ӷŵ����������������������������ɵ�����������̼��ͬʱ������HCl��
��������ӦΪ��6H2O+6e-�T6OH-+3H2������6H++6e-�T3H2������
������ӦΪ��6Cl--6e-�T3Cl2����CO��NH2��2+3Cl2+H2O�TN2+CO2+6HCl��
����������Ӧʽ���Կ��������������ϲ�����OH-��H+����Ŀ��ȣ��������з�Ӧ������H+ͨ�����ӽ���Ĥ������������OH-ǡ�÷�Ӧ����ˮ�������������е��ǰ����Һ��pH���䣻
��������Ӧʽ���Կ�����ת��6 mol e-ʱ����������3 mol H2����������1 mol N2��1 mol CO2������n=$\frac{V}{{V}_{m}}$����������������������ʵ��������������и���ֵı�����ϵ����n��N2����n��CO2�����ٸ��ݷ���ʽ�������ص����ʵ���������m=nM�������ص�������
��� �⣺��1��CO2��NH3�ϳ�CO��NH2��2������Ԫ���غ��֪��ͬʱ����H2O���ɣ���ѧ����ʽΪ��
2NH3+CO2$\frac{\underline{\;һ������\;}}{\;}$CO��NH2��2+H2O��
�ʴ�Ϊ��2NH3+CO2$\frac{\underline{\;һ������\;}}{\;}$CO��NH2��2+H2O��
��2������CO2��ת������ʱ��仯ͼ����֪��A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У��淴Ӧ���ʼ�������B�㴦��ƽ��״̬����v����CO2��С��B��ƽ��ʱ�Ļ�ѧ��Ӧ���ʣ�
�ʴ�Ϊ��С�ڣ�
����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ4a����ͼ��֪��CO2��ת����Ϊ60%����ת���Ķ�����̼Ϊa��60%=0.6a�����ݷ���ʽ��֪��ת����NH3�����ʵ���Ϊ0.6a��2=1.2a����ƽ��ʱ������ת���ʶ�Ϊ$\frac{1.2a}{4a}$��100%=30%��
�ʴ�Ϊ��30%��
��a��������Ӧ��2NH3��g��+CO2��g�� CO��NH2��2 ��s��+H2O��g��������ӦΪ�������ʵ�����С�ķ�Ӧ���淴Ӧ����ѹǿ��С�������е�ѹǿ����˵������ƽ��״̬����a��ȷ��
CO��NH2��2 ��s��+H2O��g��������ӦΪ�������ʵ�����С�ķ�Ӧ���淴Ӧ����ѹǿ��С�������е�ѹǿ����˵������ƽ��״̬����a��ȷ��
b��3mol N-H�����ѵ�ͬʱ����2molH-O����������2molH-O���Ŀ�������6molN-H���������������ʴ����������ʣ���Ӧ���淴Ӧ���У���b����
c��ƽ��ʱ������̼��ˮ��Ũ���������̼ת�����йأ�ƽ��ʱ��һ����ȣ���c����
d��c��CO2����Ũ�ȱ��ֲ��䣬˵������ƽ�⣬��d��ȷ��
��ѡ��ad��
��3������ͼ��֪�����ҵ缫����ΪCl2������������Ӧ����AΪ��Դ�����������ҵ�����H2��������ԭ��Ӧ����BΪ��Դ�ĸ������ʴ�Ϊ��B��
����ͼ��֪�������������������ӷŵ����������������������������ɵ�����������̼��ͬʱ������HCl���������з����ķ�Ӧ����Ϊ��6Cl--6e-�T3Cl2����CO��NH2��2+3Cl2+H2O�TN2+CO2+6HCl��
�ʴ�Ϊ��6Cl--6e-�T3Cl2����CO��NH2��2+3Cl2+H2O�TN2+CO2+6HCl��
��������ӦΪ6H2O+6e-�T6OH-+3H2������6H++6e-�T3H2����
������ӦΪ6Cl--6e-�T3Cl2����CO��NH2��2+3Cl2+H2O�TN2+CO2+6HCl
����������Ӧʽ���Կ��������������ϲ�����OH-��H+����Ŀ��ȣ��������з�Ӧ������H+ͨ�����ӽ���Ĥ������������OH-ǡ�÷�Ӧ����ˮ�������������е��ǰ����Һ��pH���䣻
��������Ӧʽ���Կ�����ת��6 mol e-ʱ����������3 mol H2����������1 mol N2��1 mol CO2���ʵ���ռ�����11.2 L���壬���ʵ���Ϊ$\frac{11.2L}{22.4L/mol}$=0.5mol����n��N2��=n��CO2��=0.5mol��$\frac{1}{5}$=0.1 mol��
���ݷ���ʽCO��NH2��2+3Cl2+H2O�TN2+CO2+6HCl����֪����0.1 mol N2�����ĵ�CO��NH2��2�����ʵ���ҲΪ0.1 mol��������Ϊ��m[CO��NH2��2]=0.1 mol��60 g•mol-1=6 g��
�ʴ�Ϊ�����䣻6��
���� ���⿼�黯ѧƽ��ļ��㡢��ѧƽ��״̬�жϡ�����ԭ�����йؼ��㣬��3����ע��۲�缫�����жϷ����ķ�Ӧ��ע����ݷ���ʽ�ж�������PHֵ�ı仯��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ������ȼ�� | B�� | ˮ�ĵ�� | C�� | �����ȼ�� | D�� | һ����̼��ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ij̽��С����ʵ����̽����˾ƥ�ֵĺϳɣ���Ҫԭ����ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]���Ʊ�����ʵ���������£�
��ij̽��С����ʵ����̽����˾ƥ�ֵĺϳɣ���Ҫԭ����ˮ���ᣨ���ǻ������ᣩ�������[��CH3CO��2O]���Ʊ�����ʵ���������£�
| ���� | ��Է������� | �۵��е㣨�棩 | ˮ���� |
| ˮ���� | 132 | 158���۵㣩 | �� |
| ������ | 102 | 139.4���е㣩 | ��ˮ��Ӧ |
| ����ˮ���� | 180 | 135���۵㣩 | �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
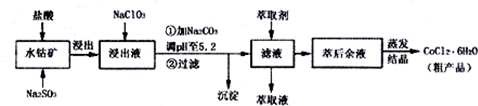
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��2 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| �¶�/�� | 0 | 100 | 200 | 300 | 400 |
| ƽ�ⳣ�� | 667 | 13 | 1.9��10-2 | 2.4��10-4 | 1��10-5 |
| A�� | �÷�Ӧ������Ӧ�����ȷ�Ӧ | |
| B�� | 100��ʱ�������ΪV1L�ĺ����ܱ������г���2mol CO��4mol H2���ﵽƽ��ʱ��CO��ת����Ϊ40%����V1=12 | |
| C�� | 250��ʱ�������ΪV2L�ĺ����ܱ������г���3mol CO��3mol H2���ﵽƽ��ʱ�����������CO���������Ϊ50% | |
| D�� | 250��ʱ�������ΪV2L�ĺ����ܱ������г���3mol CO��3mol H2���ﵽƽ��ʱ�����������CH3OH��g�����������Ϊ62.5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCN | B�� | CH3COOH | C�� | HF | D�� | HNO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �÷�Ӧ�Ļ�ѧ����ʽΪ5A+4B?4C | |
| B�� | 2minʱ���÷�Ӧ�ﵽƽ�⣬��ʱA��B��C��Ũ�ȱ�Ϊ5��4��4 | |
| C�� | ��B��Ũ�ȱ仯��ʾ0-2minʱ���ڵ�����Ϊ2mol/��L•min�� | |
| D�� | 2minǰ������Ӧ������С���淴Ӧ����������������Ӧ���ʴ����淴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��PH=a��NaOH��Һ��ˮϡ����10n��������Һ��PH��Ϊa-n | |
| B�� | ��Ũ�ȵİ�ˮ��NH4Cl��Һ�������Ϻ�c��NH${\;}_{4}^{+}$��+c��H+����c��NH3•H2O��+c��OH-�� | |
| C�� | ��NaOH��Һ����μ���CH3COOH��Һ��PH=7��ˮ�ĵ���̶������� | |
| D�� | PH=5.6��NaHSO3��Һ��c��Na+����c��HSO${\;}_{3}^{_}$����c��H2SO3����c��SO${\;}_{3}^{2-}$�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com