
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于盐酸 | |
| C. | 向50 mL 18 mol•L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol | |
| D. | 常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
分析 A.二氧化硫气体能用浓硫酸干燥,但二氧化硫有还原性;
B.BaSO4难溶于水和酸,具有不易被X射线透过的特点;
C.浓硫酸随反应进行,浓度变稀后稀硫酸和铜不反应;
D.常温下铝、铁在浓硫酸,浓硝酸中发生钝化现象.
解答 解:A.同种元素的不同价态之间若发生氧化还原反应,遵循价态归中不交叉,SO2中S显+4价,浓硫酸硫酸中S显+6价,无中间价态,所以SO2虽具有还原性气体,但不能被浓硫酸浓硫酸氧化,故A错误;
B.难溶于水也难溶于酸的BaSO4没有毒,还由于它具有不易被X射线透过的特点,在医疗上被用做X射线透视胃肠的内服药剂--“钡餐”,故B正确;
C.浓硫酸随反应进行,浓度变稀后稀硫酸和铜不反应,向50mL18mol•L-1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量小于0.45mol,故C错误;
D.常温下铝、铁在浓硫酸,浓硝酸中发生钝化,发生的是氧化还原反应生成一薄层致密的氧化物薄膜阻止反应进行,故D错误;
故选B.
点评 本题考查了物质性质的分析判断,主要是二氧化硫、硫酸钡、浓硫酸、浓硝酸和铝的性质应用,注意浓硫酸随反应进行浓度减小变化为稀硫酸不再发生反应,题目难度中等.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
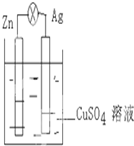 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +HO-SO3H$\stackrel{70℃~80℃}{→}$
+HO-SO3H$\stackrel{70℃~80℃}{→}$ +H2O,该反应属于( )
+H2O,该反应属于( )| A. | 置换反应 | B. | 中和反应 | C. | 复分解反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | s轨道与s轨道之间可以在任何方向上成键,所以共价键都没有方向性 | |
| D. | s轨道与p轨道只有沿着一定的方向,才能发生最大程度的重叠,形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2(g) | SO2(g) | 饱和NaHSO3溶液,浓H2SO4 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 过量的饱和碳酸钠溶液 | 分液 |
| C | Na2CO3(s) | NaHCO3(s) | 无需添加 | 灼烧 |
| D | 甲烷 | 乙烯 | 酸性KMnO4,浓H2SO4 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于碘在酒精及CCl4中的溶解度大,所以可用酒精或CCl4将碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精 | |
| C. | 苯甲酸中含有少量氯化钠,可用重结晶的方法提纯得到苯甲酸 | |
| D. | 乙酸乙酯和乙醇的混合物可以用分液的方法进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com