
| A、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ?mol-1 | ||
B、C2H2(g)+
| ||
| C、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ?mol-1 | ||
| D、2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol-1 |
| 5 |
| 2 |


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
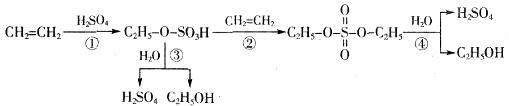
| A、该过程是一种“对环境友好型”工业生产硫酸的方法 |
| B、从以上物质的转化过程可看出硫酸可作乙烯水化法制乙醇的催化剂 |
| C、该过程中①②是加成反应 |
| D、该过程中③④是酯类的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
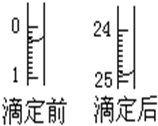 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室蒸馏石油时,冷凝管水流方向应从上到下与蒸汽流动方向相同 |
| B、蒸发结晶时不必将溶液加热到蒸干 |
| C、萃取操作必须在分液漏斗中进行 |
| D、用剩的药品应收集起来放回指定的回收处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | 5 | ||
| ⅲ | 350 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com