
| A�� | ���Һ�м�����������������Һ����ɫ����������˵����Һ�в���Cu2+ | |
| B�� | ���Һ�еμ������ữ��AgNO3��Һ��������ɫ������˵����Һ�к���Cl- | |
| C�� | ���Һ�м��������ۣ���ַ�Ӧ������ʣ�࣬˵����Һ�к���Fe3+ | |
| D�� | ���Һ�еμ�KSCN��Һ���������ټ�����ˮ���ܳ�Ѫ��ɫ��˵����Һ�к���Fe2+ |
���� ��FeCl3��Һ����ͭ��ӡˢ��·������õķ�Һ�к�Cu2+��Fe2+�������ܺ�Fe3+��������һ��ΪCl-��������ӵļ��������
��� �⣺A����������Һ��ͭ���Ӳ���Ӧ�����ܼ��飬��A����
B�����Һ�еμ������ữ��AgNO3��Һ��������ɫ��������ɫ����ΪAgCl��˵����Һ�к���Cl-����B��ȷ��
C�����Һ�м��������ۣ���ַ�Ӧ������ʣ�࣬����Fe+2Fe3+=3Fe2+��˵����Һ�к���Fe3+��������Fe��ͭ���ӵķ�Ӧ����C��ȷ��
D�����Һ�еμ�KSCN��Һ������������Һ�в���Fe3+���ټ�����ˮ���ܳ�Ѫ��ɫ��˵����Һ�к���Fe2+����D��ȷ��
��ѡA��
���� ���⿼��������ԭ��Ӧ���������ӵļ��飬Ϊ��Ƶ���㣬����Cu���Ȼ�����Ӧ����Һ�еijɷּ��������ӵļ��鷽��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 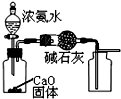 ��ȡ���ռ������NH3 | |
| B�� | 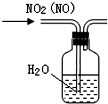 �ɳ�ȥNO2�е�NO | |
| C�� | 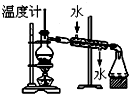 �������ֻ��ܵ��е����ϴ��Һ������ | |
| D�� | 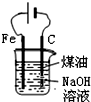 �Ʊ�Fe��OH��2���ܽϳ�ʱ��۲�����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2����ͨ��NaOH��Һ�У�������������˵��SO2��������ˮ | |
| B�� | SO2����ͨ����ˮ�У���ˮ����ɫ��ȥ��˵��SO2����Ư���� | |
| C�� | SO2����ͨ������KMnO4��Һ�У���Һ����ɫ��dz��˵��SO2���л�ԭ�� | |
| D�� | SO2����ͨ��Ba��NO3��2��Һ�У���Һ���ֻ�������˵����BaSO3�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ð״׳����⣺Fe2O3•xH2O+6H+�T��3+x��H2O+2Fe3+ | |
| B�� | ��Ba��OH��2��Һ�м���������NH4HSO4��Һ��Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$�TBaSO4��+NH3•H2O+H2O | |
| C�� | ������Һ�ͱ��ӷ�Ӧ��C${{O}_{3}}^{2-}$+2C6H5OH��2C6H5O-+CO2��+H2O | |
| D�� | �ù���������ữ�ĺ����ҽ���Һ����ȡ�⣺2I-+H2O2�TI2+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
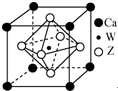 ԭ������С��36��X��Y��Z��W����Ԫ�أ�X��̬ԭ�ӵ����������������ڲ��������2����Y��̬ԭ�ӵ�2pԭ�ӹ������3��δ�ɶԵ��ӣ�Z�ǵؿ��к�������Ԫ�أ�W��ԭ������Ϊ22��
ԭ������С��36��X��Y��Z��W����Ԫ�أ�X��̬ԭ�ӵ����������������ڲ��������2����Y��̬ԭ�ӵ�2pԭ�ӹ������3��δ�ɶԵ��ӣ�Z�ǵؿ��к�������Ԫ�أ�W��ԭ������Ϊ22���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | DԪ�ش���Ԫ�����ڱ��е�3���ڵڢ��� | |
| B�� | ����Ԫ�ص�ԭ�Ӱ뾶��r��A����r��B����r��C����r��D�� | |
| C�� | B��D������������У�B��D����ԭ�Ӿ�Ϊ˫�� | |
| D�� | һ�������£�B������ת����D���ʣ�C���������û���A���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | M����Է���������178 | |
| B�� | M�л����к���2�ֹ����� | |
| C�� | M��������NaOH��Һ������Ӧʱ�������л�����Ļ�ѧʽΪC9H9O5Na | |
| D�� |  ��M��Ϊͬ���칹�� ��M��Ϊͬ���칹�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com