
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.富含硫黄的矿物在工业上可用于制造硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
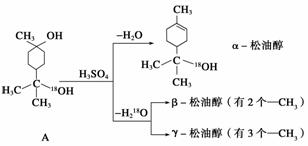
(1)α松油醇的分子式为__________。
(2)α松油醇所属的有机物类别是__________。
a.醇 b.酚 c.饱和一元醇
(3)α松油醇能发生的反应类型是______________。
a.加成 b.水解 c.氧化 d.取代
(4)写出结构简式:β松油醇____________________,γ松油醇
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应无论怎样调整反应物的用量都只能生成一种物质的是( )
A.甲烷和氯气混合后光照发生反应 B.乙烯与氯化氢的加成反应
C.甲苯与等物质的量的Br2发生反应 D.乙炔和氯气的加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量为一恒定值的是( )
A.C3H6和C3H8 B.C2H6和C2H4O2
C.C5H10和C6H6 D.C2H6和C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr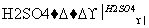 C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·mL-1);36 mL 浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题:
(1)该实验应选择下图中的a装置还是b装置________。
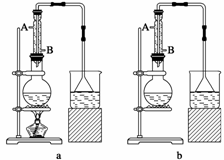
(2)反应装置中的烧瓶应选择下列哪种规格最合适( )
A.50 mL B.100 mL
C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是( )
A.A进B出 B.B进A出
C.从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)BiCl3的水解产物中有BiOCl生成。
①写出BiCl3水解反应的方程式:
________________________________________________________________________。
②医药上将BiOCl称为次氯酸铋,该名称______(填“正确”或“不正确”)。
③如何配制BiCl3溶液?
(2)室温下,将pH=2的某酸HnA与pH=12的某碱B(OH)m等体积混合后溶液的pH=8。
①若生成的盐中只有一种离子水解,该离子水解的离子方程式为
________________________________________________________________________。
②简述该混合液呈碱性的原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com