
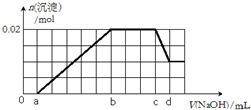
 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:分析 (1)溶液是无色透明的,所以不含有颜色的离子,故Fe3+一定不存在;
(2)通过图象知,在加入过量的过氧化钠的过程中,一开始就没有沉淀生成,说明含有H+,后来沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+;原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由图可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$,由此分析解答;
(3)原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氢氧根离子的浓度为0.01mol,0→a与氢离子反应,所以氢离子的物质的量为0.01mol,由此求原溶液确定含有Mg2+、Al3+、H+,其物质的量之比;
(4)根据图推断一定不含有CO32-、一定含有SO42-;根据①得n(SO42-)=$\frac{6.99g}{233g/mol}$=3×10-2mol;根据(2)得n(NH4+)=0.03mol,据此即可解答根据电荷守恒,阳离子的总电荷为n(Mg2+)×2+n(Al3+)×3+n(NH4+)×1+n(K+)×1+n(H+)=0.09mol+n(K+)×1,阴离子的总电荷为n(SO42-)×2+n(NO3-)×1=3×10-2mol×2+n(NO3-)×1,
阳离子的总电荷等于阴离子所带的总电荷,0.09mol+n(K+)×1═3×10-2mol×2+n(NO3-)×1,然后求出范围.
解答 解:(1)溶液是无色透明的,所以不含有颜色的离子,故Fe3+一定不存在,故答案为:Fe3+;
(2)通过图象知,在加入过量的过氧化钠的过程中,一开始就没有沉淀生成,说明含有H+,后来沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+,所以NaOH溶液滴至b~c段过程中发生的离子反应方程式为NH4++OH-=NH3•H2O,原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由图可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$=$\frac{0.01}{(d-c)×0.001}$=$\frac{10}{d-c}$mol•L-1,故答案为:NH4++OH-=NH3•H2O;$\frac{10}{d-c}$ mol•L-1;
(3)原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氢氧根离子的浓度为0.01mol,0→a与氢离子反应,所以氢离子的物质的量为0.01mol,则n(Mg2+):n(Al3+):n(H+)为1:1:1,故答案为:1:1:1;
(4)根据图推断一定不含有CO32-、一定含有SO42-;根据①得n(SO42-)=$\frac{6.99g}{233g/mol}$=3×10-2mol;根据(2)得n(NH4+)=0.03mol,据此即可解答根据电荷守恒,阳离子的总电荷为n(Mg2+)×2+n(Al3+)×3+n(NH4+)×1+n(K+)×1+n(H+)=0.09mol+n(K+)×1,阴离子的总电荷为n(SO42-)×2+n(NO3-)×1=3×10-2mol×2+n(NO3-)×1,
阳离子的总电荷等于阴离子所带的总电荷,0.09mol+n(K+)×1═3×10-2mol×2+n(NO3-)×1,
因K+不能和中学常见物质反应产生特殊现象进行判断,只能用焰色反应判断,该实验无法判断其是否存在,所以n(NO3-)≥0.03mol,所以c(NO3-)≥0.3 mol•L-1
,故答案为:c(NO3-)≥0.3 mol•L-1.
点评 本题主要考查了离子的共存、反应的计算,定性分析离子共存、定量分析离子的物质的量是解题的关键,题目难度中等.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
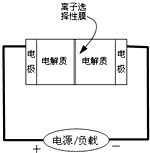 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: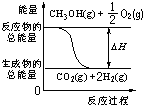 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
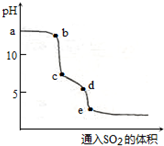 PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com