
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
分析 (1)弱酸的酸性越弱,其酸根的水解能力越强;
(2)NaHCO3溶液显碱性,碳酸氢根离子的电离程度很小;
(3)6种盐溶液都是强碱弱酸盐,都促进了盐的水解,溶液的pH越大,溶液中氢氧根离子浓度越大,则水解程度越大,水的电离程度越大,NaHSO3pH小于7说明亚硫酸氢根离子的电离程度大于水解程度,抑制了水的电离;
(4)氯气与水反应生成盐酸和次氯酸,加入酸性比盐酸弱比次氯酸强的酸对应的盐即可;
(5)弱酸的电离程度和弱酸根的水解程度都很小,H2SO3和NaHSO3混合液能够形成缓冲溶液.
解答 解:(1)据碳酸钠、硅酸钠和亚硫酸钠的pH可知,亚硫酸的酸性比碳酸强,碳酸的酸性比硅酸强,故答案为:B>C>A;
(2)碳酸氢根离子的电离程度很小,c(CO32-)很小,加入氯化钙溶液后Qc<Ksp(CaCO3)不能产生沉淀,
故答案为:HCO3-的电离程度很小,c(CO32-)很小,Qc<Ksp(CaCO3)不能产生沉淀;
(3)6种溶液中,NaHSO3溶液的pH小于7,说明亚硫酸氢根离子的电离程度大于水解程度,抑制了水的电离,故答案为:NaHSO3;
(4)氯气与水反应生成盐酸和次氯酸,加入酸性比盐酸弱比次氯酸强的酸对应的盐,可以与盐酸反应,平衡正向移动,次氯酸浓度增大,或直接加入次氯酸钠,不能加入硅酸钠,因为能够生成沉淀,故答案为:NaHCO3或NaClO;
(5)向H2SO3和NaHSO3混合液中加入少量强酸时,能够生成亚硫酸,加入少量强碱时,能够生成亚硫酸氢根离子,溶液的pH变化不大,
故答案为:加碱发生反应:H2SO3+OH-═HSO${\;}_{3}^{-}$+H2O; 加酸发生反应:HSO${\;}_{3}^{-}$+H+═H2SO3.
点评 本题考查了盐的水解原理及其影响因素、离子浓度大小比较,题目难度中等,正确理解盐的水解原理及其影响为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 (苯胺,易被氧化)
(苯胺,易被氧化)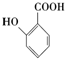 的名称为邻羟基苯甲酸;
的名称为邻羟基苯甲酸; ;
; ;
; 的合成路线.(无机试剂任用)
的合成路线.(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO${\;}_{3}^{-}$、CH3CHO不能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生22.4LCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2<$\frac{{Q}_{1}}{2}$ | C. | Q2>$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为H2O和D2O的性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a和途径b放出的热能相等 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O,途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 氢氧燃料电池的能量转换形式仅为化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
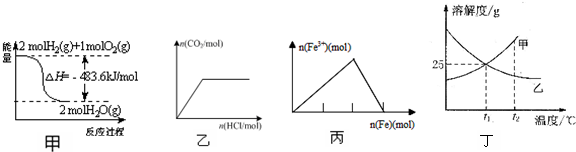
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 | |
| C. | 丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+浓度的变化曲线 | |
| D. | 丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1 mol Na2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17 g NH3所含电子数之比为9:10 | |
| D. | 1mol Na2CO3晶体中含 CO${\;}_{3}^{2-}$离子数小于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com