
| A. | 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol•L-1•s-1 | |
| B. | c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间小于10 s | |
| C. | 升高温度正反应速率加快,逆反应速率减慢 | |
| D. | 减小反应体系的体积,化学反应速率加快 |
分析 A.0~15s内c(HI)由0.1mol•L-1降到0.07mol•L-1,v(HI)=$\frac{0.03mol/L}{15s}$=0.002mol/(L.s),结合速率之比等于化学计量数之比计算v(H2);
B.若速率不变,c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间为$\frac{0.02mol/L}{0.002mol/(L.s)}$=10s,但随反应进行浓度减小,反应速率减小;
C.升高温度,正逆反应速率均增大;
D.减小反应体系的体积,压强增大.
解答 解:A.0~15s内c(HI)由0.1mol•L-1降到0.07mol•L-1,v(HI)=$\frac{0.03mol/L}{15s}$=0.002mol/(L.s),由速率之比等于化学计量数之比可知v(H2)=0.002mol/(L.s)×$\frac{1}{2}$=0.001mol/(L.s),但I2(s)为固体,不能表示反应速率,故A错误;
B.若速率不变,c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间为$\frac{0.02mol/L}{0.002mol/(L.s)}$=10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 mol•L-1降到0.05 mol•L-1所需的反应时间大于10 s,故B错误;
C.升高温度,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,故C错误;
D.减小反应体系的体积,压强增大,则化学反应速率加快,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握速率的影响因素及计算方法为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 萃取 | B. | 吸附 | C. | 结晶 | D. | 蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

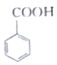 (苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$
(苯甲酸)+C2H5OH$?_{△}^{浓硫酸}$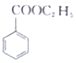 (苯甲酸乙酯)+H2O
(苯甲酸乙酯)+H2O| 物质 | 苯甲酸 | 乙醇 | 苯甲酸乙酯 |
| 熔点/℃ | 122.1 | -117.3 | -34.6 |
| 沸点/℃ | 249 | 78.3 | 213 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
| 向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
 它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.
它与水反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
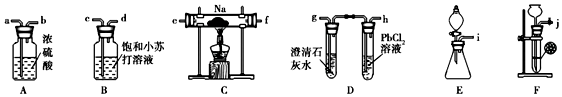
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②④ | C. | ①③④⑦ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com