
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.S(g)+O2(g)=SO2(g), △H1; S(s)+O2(g)=SO2(g), △H2
B.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l), △H2
C.C(s)+  O2(g)=CO(g) △H1;C(s)+O2(g)=CO2(g)
△H2
O2(g)=CO(g) △H1;C(s)+O2(g)=CO2(g)
△H2
D.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2
科目:高中化学 来源: 题型:阅读理解
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | ||||||||
| 乙炔 | CaCO3
| |||||||
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.H2与O2总是按照质量比1∶8的关系发生化学反应
B.在同温同压下,H2的体积总是随着H2分子数的递增而增大
C.MnO2可使KClO3加快分解
D.不同的元素,其金属性、非金属性各不相同。但在所有元素内,其金属性、非金属性的差异是有规律的
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中可用元素周期律作解释的是…( )
A.H2与O2总是按照质量比1∶8的关系发生化学反应
B.在同温同压下,H2的体积总是随着H2分子数的递增而增大
C.MnO2可使KClO3加快分解
D.不同的元素,其金属性、非金属性各不相同。但在所有元素内,其金属性、非金属性的差异是有规律的
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省定州中学高考复习综合测试化学试卷(带解析) 题型:计算题
(10分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| | 原料生产工艺过程 |
| 乙炔 | 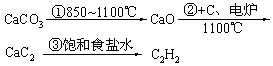 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高考复习综合测试化学试卷(解析版) 题型:计算题
(10分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
|
|
乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
___________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是_____________________________。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com