
【题目】某研究小组制备氯气并对产生氯气的条件进行探究。

(1)装置A中用MnO2与浓盐酸反应制取Cl2,利用了浓HCl的___________(填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________。
(3)B用于收集Cl2,请完善装置B并用箭头标明进出气体方向_____________。
(4)C用于吸收多余的Cl2,C中发生反应的离子方程式是____________________________________________________________。
(5)该小组欲研究盐酸的浓度对制Cl2的影响,设计实验进行如下探究。

①已知MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是___________________________________________________。
②Ⅱ中发生了分解反应,反应的化学方程式是__________________________________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是____________________________;
将ⅰ、ⅱ作对比,得出的结论是___________________________________。
【答案】还原性 HCl、H2O(g) 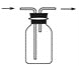 Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
Cl2+2OH-=Cl-+ClO-+H2O MnO2+4HCl=MnCl4+2H2O MnCl4=Cl2↑+MnCl2 Ⅲ中没有明显现象的原因是c(H+)、c(Cl-) 较低,需要增大到一定浓度才能被MnO2氧化 MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)
【解析】
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,元素失电子化合价升高发生氧化反应,元素得电子化合价降低发生还原反应;
(2)MnO2与浓盐酸反应制取Cl2中混有氯化氢和水蒸气;
(3)氯气的密度比空气的密度大,采用向上排空气法收集氯气;
(4)C中氢氧化钠溶液用于吸收多余的Cl2,生成氯化钠、次氯酸钠和水;
(5)①复分解反应为两种化合物相互交换成分生成另外两种化合物;
②将Ⅰ中混合物过滤,加热滤液,Ⅱ中发生了分解反应,结合氧化还原反应单质守恒分析锰元素被还原的价态和物质;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将ⅰ、ⅱ做对比加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度。
(1)二氧化锰和浓盐酸在加热的条件下反应生成氯气,氯元素化合价升高,锰元素的化合价降低,氯化氢做还原剂,利用氯化氢的还原性;
(2)用MnO2与浓盐酸在加入条件下反应制取Cl2,浓盐酸中的氯化氢易挥发,故Cl2含有杂质为HCl、H2O(g);
(3)氯气的密度比空气的密度大,采用向上排空气法,长导管进气,短导管出气,收集氯气的装置图为: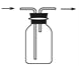 ;
;
(4)C用于吸收多余的Cl2,防止污染环境,C中发生反应的离子方程式是:Cl2+2OH-![]() Cl-+ClO-+H2O;
Cl-+ClO-+H2O;
(5)①MnO2呈弱碱性。 Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,酸碱中和反应生成盐和水,化学方程式是:MnO2+ 4HCl=MnCl4+2 H2O;
②Ⅱ中发生了分解反应,将Ⅰ中混合物过滤,加热滤液分解生成MnCl2和Cl2,反应的化学方程式是:MnCl4= MnCl2+Cl2↑;
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,将实验Ⅲ、Ⅳ作对比,得出的结论是Ⅲ中无明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度,才能被MnO2氧化,将ⅰ、ⅱ作对比,加热MnO2和4mo![]() L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
L-1稀盐酸混合物,加热硫酸和加入氯化钠当生成黄绿色气体,其中氢离子浓度小于氯离子的浓度,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。


科目:高中化学 来源: 题型:
【题目】某学生用12mol·L-1的浓盐酸配制0.10mol·L-1的稀盐酸500 mL。回答下列问题。
(1)关于容量瓶的使用,下列操作正确的是___(填序号)。
a.使用前要检验容量瓶是否漏液
b.用蒸馏水洗涤后必须要将容量瓶烘干
c.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行
d.为了使所配溶液浓度均匀,定容结束后,要摇匀
e.用500mL的容量瓶可以直接配制480mL溶液
f.当用容量瓶配制完溶液后,可用容量瓶存放配制的试剂
(2)量取浓盐酸的体积为___mL,应选用的量筒规格为___(填“10mL”“25mL”或“50mL”)。
(3)配制时应选用的容量瓶规格为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖转化成葡萄糖内酯并获得能量。下列说法正确的是
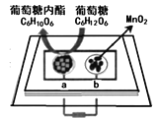
A.a极为正极
B.外电路电子移动方向为b到a
C.b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
D.当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
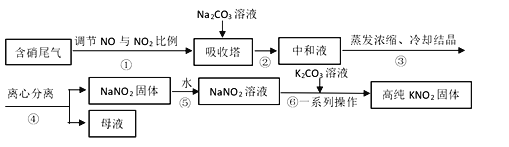
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
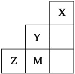
A.电负性:Z>M>Y
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的组成、结构或性质的叙述中,正确的是
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
⑥次氯酸分子的电子式:![]()
⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6,两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
A.①③④⑦⑧B.⑤⑧⑨C.②③⑤⑥⑦⑨D.②⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯雌酚是人工合成的激素药物,能改善体内激素的平衡状态,其结构如图。下列有关叙述错误的是( )
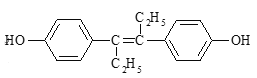
A.乙烯雌酚能发生取代、加成、氧化反应
B.乙烯雌酚可分别与NaOH、NaHCO3溶液反应
C.每1mol该有机物最多可以与含5molBr2的溴水反应
D.该有机物分子中最多有18个碳原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com