
| 2.52g |
| 126g/mol |
| 2.52g |
| 126g/mol |
| 5 |
| 2 |
| 100mL |
| 25mL |
| 8.8V×10-3g |
| mg |
| 0.88V |
| m |
| 0.88V |
| m |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 一定条件 |
 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )| A、①④ | B、①③ | C、② | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
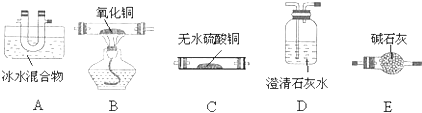
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
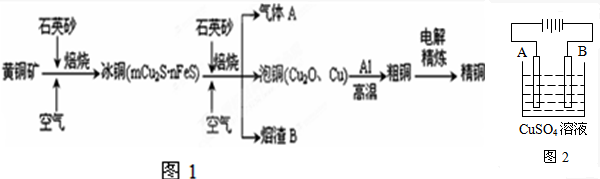
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研发可降解高分子材料,减少塑料制品的使用 |
| B、倡导“低碳经济”,减少对化石燃料的依赖 |
| C、通过“静电除尘”、“燃煤固硫”和“汽车尾气催化净化”提高空气质量 |
| D、采用露天焚烧或深埋的方法处理所有垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
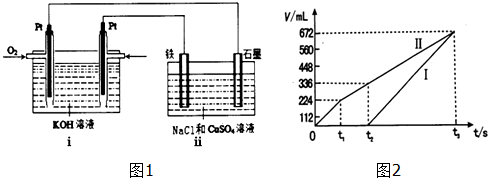
A、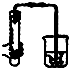 双手移去后,导管中水面与烧杯水面相平,则说明装置不漏气 |
B、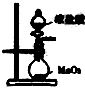 用于实验室制取Cl2 |
C、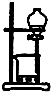 从海带中提取碘的实验过程中,用如图装置向烧杯中放出碘的苯溶液 |
D、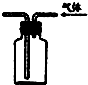 可用于实验室收集甲烷气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:在试管中加入MnO2,然后滴加4mol/L稀盐酸, | |
| 步骤2:在试管中加入MnO2,然后滴加4mol/L稀盐酸, |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有④ | B、只有②③ |
| C、只有③④ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com