
分析 (1)Cu与浓硝酸反应生成二氧化氮和硝酸铜;
(2)随着反应的进行,浓硝酸变为稀硝酸,则铜和稀硝酸反应生成一氧化氮和硝酸铜;
(3)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量.
解答 解:(1)因反应开始硝酸的浓度大,反应剧烈,反应生成硝酸铜溶液、二氧化氮和水,其反应方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
(2)随着反应的进行,浓硝酸变为稀硝酸,则铜和稀硝酸反应生成一氧化氮和硝酸铜,其反应方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
(3)12.8gCu的物质的量=$\frac{12.8g}{64g/mol}$=0.2mol,气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;反应转移电子的物质的量为0.2mol×2=0.4mol,
故答案为:0.65mol;0.4mol.
点评 本题考查了硝酸的性质及氧化还原反应计算,难度中等,注意利用氮原子个数守恒和得失电子数守恒思想计算.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制80mL 1.0mol•L-1CuSO4溶液 | 将25g CuSO4•5H2O溶于蒸馏水配制成100mL溶液 |
| B | 除去KCl中少量KClO3 | 将混合物(加少量MnO2)置于坩埚中灼烧至固体质量不再减少 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 200mL1mol/LAl2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
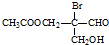 经过以下反应仍具有光学活性的是( )
经过以下反应仍具有光学活性的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液反应 | ||
| C. | 与银氨溶液作用只发生银镜反应 | D. | 催化剂作用下与H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH --2e -═Fe(OH) 2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH) 2+2OH --2e -═Ni 2O 3+3H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| X | NaHCO3 | AlCl3 | NaHCO3 | MgCl2 |
| Y | Ca(OH)2 | NaOH | HCl | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家庭消毒时,消毒液越浓越好 | |
| B. | 烹饪时用“加碘食盐”可预防“非典” | |
| C. | 应经常保持室内清洁卫生和通风 | |
| D. | 必须每天吃药,补充人体所需化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可以用于治疗胃酸过多 | |
| B. | 过氧化钠可做航天员的供氧剂 | |
| C. | 金属钠有强还原性,能和硫酸铜溶液反应,但不能析出金属铜 | |
| D. | 为使面包松软可口可用碳酸氢钠做发泡剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com