
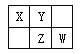
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
【答案】 第三周期第ⅤA族 HNO3> H3PO4> H2CO3 C2N2或N2C2 N≡C—C≡N C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O 36g
CO2↑+2SO2↑ + 2H2O 36g
【解析】首先利用Z的核外电子排布特点判断出Z,进而结合元素在周期表中的位置判断其余元素,最后依据元素周期律和相关物质的性质分析解答。
短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,Z位于第三周期,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,则(1)Z为P,原子结构中有3个电子层,最外层电子数为5,则位于元素周期表中的第三周期,第VA族;(2)非金属性S>P>C,非金属性越强,最高价含氧酸的酸性越强,因此酸性强弱顺序是HNO3> H3PO4> H2CO3;(3)C和N形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,所以分子中碳原子个数介于![]() 和
和![]() ,因此该化合物的分子中碳原子个数2,则相对分子质量是
,因此该化合物的分子中碳原子个数2,则相对分子质量是![]() ,所以氮原子个数是
,所以氮原子个数是![]() ,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)
,则分子式为C2N2或N2C2,该分子中各原子最外层均满足8电子稳定结构,所以其结构式为N≡C—C≡N;(4)碳和浓硫酸在加热条件下反应的方程式为C + 2H2SO4(浓)![]() CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。
CO2↑+2SO2↑ + 2H2O;碳元素化合价从0价升高到+4价,失去4个电子,因此每转移12mol电子,消耗3mol碳,质量是36g。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,
2PbSO4+2H2O,
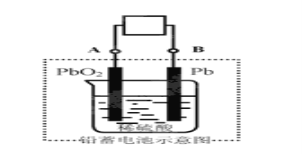
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4
C.充电时:铅蓄电池的负极应与充电器电的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的单质X、Y、Z在通常状况下均为气态,并存在下列转化关系(反应条件略去):
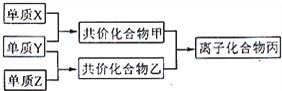
已知:在常见双原子单质分子中,X分子含共价键最多;甲分子含10个电子,乙分子含18个电子.
回答下列问题:
(1)X的电子式是_________.
(2)实验室可用图1所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲.
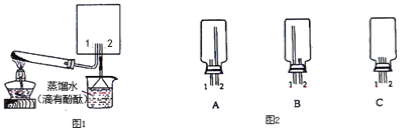
①从装置(图2)中选出图1方框内收集甲的装置是__________.
②试管中发生的化学反应方程式是 ________________________.
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对地球上的生物相当重要,它是许多食物和肥料的重要成分。氨也是制造硝酸、化肥、炸药 的重要原料。氨在国民经济中占有重要地位。回答下列问题:
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______________。
②若起始时向容器内放入1 mol N2和3 mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为____________;若在同体积的容器中充人2 mol N2和6 molH2,达平衡后放出的热量为Q2 kJ,则Q2__________(填“>”、“<”或“=”)2Q1。
③已知:

1 mol N-H键断裂吸收的能量约等于__________kJ。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2 (g)![]() 2NH3 (g),其平衡常数K与温度T的关系如下表:
2NH3 (g),其平衡常数K与温度T的关系如下表:
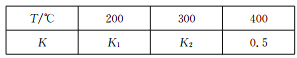
①平衡常数表达式K=_________,K1___________(填“>”、“<”或“一”)K2。
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是__________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1: 3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2 mol、1 mol、2 mol时,则此时该反应_________(填“处于”或“不处于”)平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、Si是构成无机非金属材料的重要元素。
(1)Si在周期表中的位置为_____________。
(2)为比较C、Si的非金属性,某同学设计了如下实验:

装置①中盛放的试剂是________,装置②中发生反应的离子方程式是_____________。
(3)SiC是一种重要的高温耐磨材料。SiC中,C元素显________(填“正”或“负”)化合价,从原子结构角度解释原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )
A.②④
B.③⑤
C.①②④
D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com