
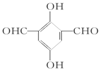
 说法正确的是( )
说法正确的是( )| A. | 1 molA能与4 mol Ag(NH3)2OH溶液发生银镜反应 | |
| B. | 核磁共振氢谱图显示有三个吸收峰 | |
| C. | 不能与FeCl3溶液发生显色反应 | |
| D. | 1 mol A能与2 mol NaHCO3完全反应放出CO2 |
分析 该物质中含有醛基、酚羟基和苯环,具有醛、酚和苯的性质,能发生氧化反应、还原反应、加成反应、取代反应、显色反应等,据此分析解答.
解答 解:A.该分子中含有两个醛基,所以1 molA能与4 mol Ag(NH3)2OH溶液发生银镜反应,故A正确;
B.该分子中含有4种氢原子,所以核磁共振氢谱有4个吸收峰,故B错误;
C.含有酚羟基,所以能与氯化铁溶液发生显色反应,故C错误;
D.不含羧基,所以不能和碳酸氢钠反应,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查酚、醛的性质,注意酚羟基和碳酸钠反应但和碳酸氢钠不反应,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用新制氢氧化铜悬浊液可以鉴别有机物中是否含醛基 | |
| B. | 所有的醇都可以发生消去反应生成烯烃 | |
| C. | 羧酸不一定可以与碳酸钠溶液反应 | |
| D. | 苯酚的酸性很弱,不能使指示剂变色,但可以和碳酸氢钠溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1160 | B. | 2308 | C. | 1441 | D. | 2320 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的反应,置换反应一定都属于氧化还原反应 | |
| B. | 简单非金属阴离子只有还原性,而金属阳离子只有氧化性 | |
| C. | 离子化合物在熔融态都能够导电,共价化合物在熔融态都不导电 | |
| D. | 所有物质都有化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
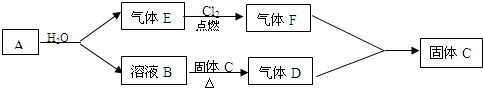
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
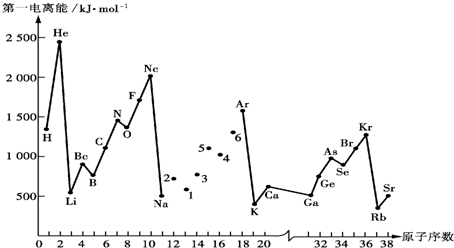
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
| C--C | C--N | C--S | |
| 键能 KJ/mol | 347 | 305 | 259 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com