
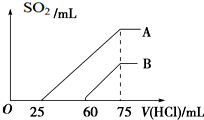
 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.| 7.5×10-3mol |
| 50×10-3L |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
| A、NaHSO4═Na++HSO4- |
| B、Na2CO3═2Na++CO32- |
| C、MgCl2═Mg2++2Cl2- |
| D、Ba(OH)2═Ba2++(OH)2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保护地球上的森林资源 |
| B、增加城市绿地面积 |
| C、禁止使用石油、煤碳等化石燃料 |
| D、限制CO2气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、25% |
| C、33% | D、50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
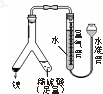 用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )
用如图所示实验装置测定某温度下气体摩尔体积,有关叙述错误的是( )| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、可用来测定镁的相对原子质量 |
| C、读取气体体积时水准管的水面高于量气管的水面,可导致测定结果偏高 |
| D、金属镁中含有少量杂质铝,可导致测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1 | B、1:3 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com