
| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 点燃爆竹后,硫燃烧生产SO3 | |
| C. | 海水中含有溴元素,只进行物理变化就可以得到溴单质 | |
| D. | “地沟油”禁止使用,但可以用来制取肥皂 |
分析 A.二氧化硅是光导纤维主要成分,硅是制造太阳能电池原料;
B.硫燃烧生成二氧化硫;
C.可从化合价的变化判断;
D..“地沟油”主要成分是油脂.
解答 解:A.光纤通信使用的光缆主要成分是二氧化硅,太阳能电池使用的材料主要是Si,故A错误;
B.点燃爆竹后,硫燃烧生产SO2,故B错误;
C.海水中含有的溴元素是以Br-的形式存在,要转化为溴单质,元素必然降价,要发生还原反应,即只经过物理变化不能从海水中得到溴单质,故C错误;
D..“地沟油”禁止食用,但其主要成分是油脂,在碱性溶液中发生水解反应,又称皂化反应,可用于制取肥皂,故D正确;
故选D.
点评 本题考查了元素化合物知识,明确硅及二氧化硅的性质及用途,海水提溴的过程、地沟油的成分及性质是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 键能 | 沸点 | 离子半径 |
| Be>B | C-C>Si-Si | H2S<H2O | Al3+<O2- |
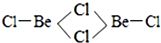
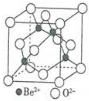
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
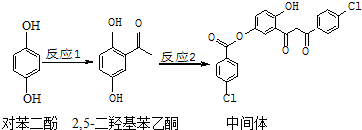
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg、Al | B. | Mg、Fe | C. | Zn、Fe | D. | Al、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
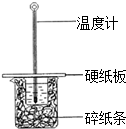 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com