
�������ʵ���һ���ļ����ij�л���A(����ʽΪCaHbOc��a��1��c��1��bΪ������)�Ļ���
(1)��������м����A�����Ժ��ֱ�����ϣ�����ȫȼ�������ɵ�ˮ�����ʵ������䣬��A����ɱ�������������� �����ϴ�������A�У���Է���������С��A�ķ���ʽΪ ��
(2) ��������м����A�����Ժ��ֱ�����ϣ�����ȫȼ�������ĵ����������ɵ�ˮ�����ʵ��������䣬���ϴ�������A�У���Է���������С��A�ķ���ʽΪ ��
(3) ���л���CxHy(x��yΪ������)��CaHbOc(a��x)�����Ժ��ֱ�����ϣ�ֻҪ�����������ʵ���һ������ȫȼ��ʱ�����ĵ����������ɵ�ˮ�����ʵ��������䣬��ô���������л������ɱ��������������(�ú�x��y��a��b��c�ȵĴ���ʽ��ʾ)
��
 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼ���мס�����������������ɱ䣬ѹǿ���䣬�ұ���������䣮���������зֱ����1mol A��3mol B����ʱ�����������Ϊ0.5L���¶�ΪT�棬�����¶Ȳ��䷢����Ӧ��A��g��+3B��g��?xC��g��+2D��s�����������з�Ӧ��4min����n��A��=0.5mol��v��c��=0.5mol?L-1?min-1��
��ͼ���мס�����������������ɱ䣬ѹǿ���䣬�ұ���������䣮���������зֱ����1mol A��3mol B����ʱ�����������Ϊ0.5L���¶�ΪT�棬�����¶Ȳ��䷢����Ӧ��A��g��+3B��g��?xC��g��+2D��s�����������з�Ӧ��4min����n��A��=0.5mol��v��c��=0.5mol?L-1?min-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?������ģ��A��B��C��D����ǰ18��Ԫ����ɵ����ֳ��������DΪ����ɫ���壬�ס��������ֵ��ʣ���Щ���ʺͻ�����֮�������ͼ��Ӧ��ϵ��
��2010?������ģ��A��B��C��D����ǰ18��Ԫ����ɵ����ֳ��������DΪ����ɫ���壬�ס��������ֵ��ʣ���Щ���ʺͻ�����֮�������ͼ��Ӧ��ϵ��| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��ʼŨ�� | �� | �� | �� |
| c��H2��/mol/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/mol/L | 0.010 | 0.010 | 0.020 |
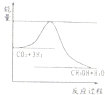
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ����������һ�и߶����ϣ����л�ѧ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�����и������ϣ����л�ѧ�Ծ��������棩 ���ͣ������
| ��ʼŨ�� | �� | �� | �� |
| c��H2��/mo1/L | 0.010 | 0.020 | 0.020 |
| c��CO2��/moI/L | 0.010 | 0.010 | 0.020 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com