
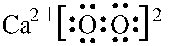 ;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.
;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.分析 (1)过氧化钙中,钙离子与过氧根离子通过离子键结合,过氧根离子内部两个氧原子通过共用1对电子结合;
过氧化钙受热分解生成氧化钙和氧气;
(2)草酸具有还原性,能够被酸性的高锰酸钾氧化生成二氧化碳,本身被还原为二价锰离子;
(3)化学平衡常数为反应物浓度幂之积与生成物浓度幂之积比值;
(4)在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,据此书写热化学方程式;
(5)A.蔗糖水解生成葡萄糖和果糖;
B.淀粉水解生成葡萄糖;
C.油脂水解生成甘油和高级脂肪酸;
D.蛋白质水解生成氨基酸.
解答 解:(1)过氧化钙中,钙离子与过氧根离子通过离子键结合,过氧根离子内部两个氧原子通过共用1对电子结合,电子式为: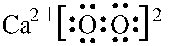
过氧化钙受热分解生成氧化钙和氧气,化学方程式:2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑;
故答案为: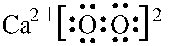
(2)草酸具有还原性,能够被酸性的高锰酸钾氧化生成二氧化碳,本身被还原为二价锰离子,离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
(3)反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数的表达式为K=$\frac{[C{O}_{2}]}{[CO]}$;
故答案为:$\frac{[C{O}_{2}]}{[CO]}$;
(4)3.8g NaBH4(s)物质的量为0.1mol,在25℃、101kPa下,每消耗0.1molNaBH4(s)放热21.6kJ,则消耗1molNaBH4(s)放热216.0kJ,则热化学方程式为NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol,
故答案为:NaBH4(s)+2H2O(l)=NaBO2(s)+4H2(g)△H=-216.0kJ/mol;
(5)A.蔗糖水解生成葡萄糖和果糖,故A不选;
B.淀粉水解生成葡萄糖,故B不选;
C.油脂水解生成甘油和高级脂肪酸,故C选;
D.蛋白质水解生成氨基酸,故D选;
故选:CD.
点评 本题为综合题,涉及电子式、化学方程式、离子方程式、热化学方程式的书写、化学平衡常数表达式的书写,明确物质的结构及相关概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾既可用于净水,又可杀菌消毒 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | 双氧水可用于杀菌、消毒、漂白 | |
| D. | 家中发生天然气泄漏,不能在室内用电话报警 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )
向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)(即Cl2与FeI2的物质的量之比)的变化可用如图简单表示(“-”表示铁各种价态的变化,用“-•-”表示碘各种形态的变化).下列结论错误的是( )| A. | Cl2、I2、IO3-、Fe3+的氧化性依次减小 | |
| B. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=1.2时,反应的离子方程式为2Fe2++10I-+6Cl2═5I2+2Fe3++12Cl- | |
| C. | 当$\frac{n(C{l}_{2})}{n(Fe{I}_{2})}$=6.5时,溶液中$\frac{n(C{l}^{-})}{n(I{O}_{3}^{-})}$=6.5 | |
| D. | 若溶液的体积不变,则溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用灼烧的方法区别丝绸与棉布 | |
| B. | 可用焰色反应区别硫酸钠和硫酸钾 | |
| C. | 可用结晶的方法分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃) | |
| D. | 可用分液的方法分离汽油和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com