
分析 电解饱和食盐水阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,依据电解原理分析,书写电池反应,依据生成的气体总体积,计算H2的物质的量和生成NaOH物质的量浓度,据此计算;
解答 解:(1)电解饱和食盐水阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,反应的离子方程式为:2NaCl+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2NaOH; 电解一段时间后两极共收集到标准状况下的气体22.4L,物质的量为1mol,依据方程式生成等物质的量的氢气和氯气,所以生成H2的物质的量为$\frac{1mol}{2}$=0.5mol,
答:生成H2的物质的量为0.5mol;
(2)依据方程式,由生成的氢气为0.5mol,所以生成NaOH物质的量为0.5mol×2=1mol,c(NaOH)=$\frac{1mol}{0.5L}$=2mol/L;
答:该溶液的NaOH物质的量浓度为2mol/L.
点评 本题考查了电解池原理和计算应用,抓住电解的总反应进行计算是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.25mol•L-1 | C. | 0.025mol•L-1 | D. | 0.125mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数 | B. | 原子数 | C. | 中子数 | D. | 电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
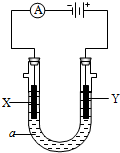 有人设计了如图所示的一个电解氯化钠溶液的装置,a为饱和食盐水,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题:
有人设计了如图所示的一个电解氯化钠溶液的装置,a为饱和食盐水,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol水中含有NA个H2O分子 | |
| B. | 1g氢气含有NA个H2分子 | |
| C. | 2mol钠与过量稀盐酸反应生成NA个H2分子 | |
| D. | 16g氧气中含有NA个氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com