
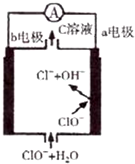
 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )| A. | 电池工作时,正极a附近的pH将不断增大 | |
| B. | 电池工作时,C溶液中的溶质是MgCl2 | |
| C. | 负极反应式:ClO-+2e-+H2O=Cl-+2OH- | |
| D. | b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl- |
分析 该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,据此分析.
解答 解:A.放电时正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以a附近的PH将不断增大,故A正确;
B.根据电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,所以C溶液中的溶质不含镁离子,故B错误;
C.根据电池反应式为:Mg+ClO-+H2O=Mg(OH)2+Cl-,负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,故C错误;
D.由可知b电极为正极发生还原反应,反应式为:ClO-+H2O+2e-=Cl-+2OH-,所以每转移0.1mol电子,理论上生成0.05mol Cl-,故D错误;
故选A.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-a}{V}$ mol•L-1 | B. | $\frac{2b-a}{V}$mol•L-1 | C. | $\frac{b-a}{V}$mol•L-1 | D. | $\frac{2(2b-a)}{V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AsH3的热稳定性大于H2S | B. | 砷的原子半径小于磷的原子半径 | ||
| C. | 砷的电负性大于溴 | D. | 基态砷原子有3个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是4He的同分异构体 | B. | 比 4He少一个中子 | ||
| C. | 比4He少一个质子 | D. | 3He原子核有3个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
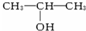 与NaOH的醇溶液共热制备CH3-CH=CH2.
与NaOH的醇溶液共热制备CH3-CH=CH2.| A. | ①③⑥ | B. | ③⑤⑥ | C. | ②③④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Fe | FeCl3 | Fe(OH)3 |
| D | Al(OH)3 | Na[Al(OH)4] | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化铬作还原剂 | B. | 乙醇作还原剂 | ||
| C. | CrO3中Cr被氧化 | D. | 乙醇发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com