
【题目】下列物质属于纯净物的是( )
A.氨水B.漂白粉C.液氯D.碘酒
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是

A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
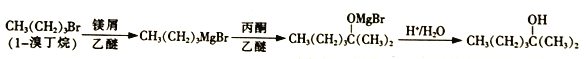
已知:RMgBr化学性质活泼,易与H2O、R'X等发生反应生成RH、R-R'。
(1)仪器A的名称是___________。
(2)引发CH3(CH2)3Br与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是_____,若镁屑不足,则反应时生成的有机副产物为________(填结构简式)。

(3)干燥管中无水氯化钙的作用为__________。
(4)加入丙酮及稀硫酸时均需用冰水冷却,这是因为_________。
(5)起始加入三颈烧瓶的1-溴丁烷的体积为5mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。
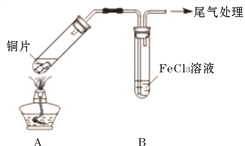
①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________。
(3)已知:B中溶液变红的反应:Fe3++6SO2 ![]() Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的为( )
A.气体摩尔体积就是22.4 L/mol
B.1 mol H2的质量只有在标况下才约为2 g
C.标况下,18克H2O的体积为22.4 L
D.H2和O2的混合气体1 mol在标况下的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且常温常压下为气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
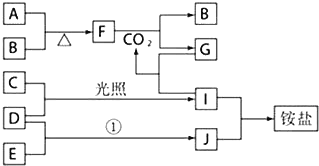
请按下列要求填空:
(1)CO2的电子式____.A的原子结构示意图________,
(2)化合物I的沸点比J的沸点____(填“高”或“低”),理由是 _________。
(3)化合物F中,阳离子与阴离子个数比是____。
(4)写出F和CO2反应的化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com