
【题目】某种胃药中抗酸剂为CaCO3。甲、乙两同学为测定其中CaCO3含量,分别设计以下两种方案(药片中的其它成分与HCl和NaOH溶液均不反应)。请回答下列有关问题:
(1)甲同学拟用下图装置测量样品与足量稀盐酸反应生成CO2的体积,来分析CaCO3的含量。则
①X的作用是__________。
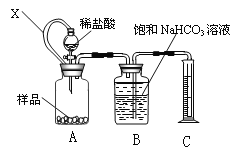
②B中不可改用饱和Na2CO3溶液,用离子方程式说明理由_______。
(2)乙同学拟用以下操作测定样品中CaCO3含量:A.配制0.100 mol/L HCl溶液和0.100 mol/L NaOH溶液,B.取一粒药片(0.100 g),研碎后加入20 mL蒸馏水,C.加入30 mL 0.100 mol/L 的盐酸,充分反应,D.用0.100 mol/L NaOH溶液中和过量的盐酸至中性,共消耗NaOH溶液18.00 mL,该胃药中CaCO3的质量分数是____写出计算过程)。
(3)甲同学将实验中获得的17.92 mL CO2 (标准状况)通入10 mL 0.100 mol/L NaOH溶液中,判断所得溶液的溶质是_____(填化学式)。
【答案】使广囗瓶内与分液漏斗内气体压强相等 ,便于溶液顺利流下 CO32-+CO2+H2O=HCO3- 60% Na2CO3 NaHCO3
【解析】
(1)①装置A中连通管X能使分液漏斗和广口瓶中的压强保持一致,使盐酸顺利流下;②碳酸钠溶液能够和二氧化碳反应;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为18.00 mL,则与碳酸钙反应的盐酸为30.00mL-18.00 mL=12.00 mL,根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再计算质量分数;
(3)计算出二氧化碳的物质的量和氢氧化钠的物质的量,然后根据二者物质的量关系判断溶液中溶质的组成。
(1)①连通管X能使漏斗和广口瓶中的压强保持一致,使盐酸顺利流下,故答案为:使广口瓶内与分液漏斗内气体压强相等,便于溶液顺利流下;
②若用碳酸钠溶液,碳酸钠会吸收二氧化碳,发生的反应为:CO32-+CO2+H2O=HCO3-,导致生成的二氧化碳被消耗,测定结果偏小,故答案为:CO32-+CO2+H2O=HCO3-;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为18.00 mL,则与碳酸钙反应的盐酸为30.00mL-18.00 mL=12.00 mL,
CaCO3 + 2HCl = CaCl2+H2O+CO2↑
100g 2mol
m(CaCO3) 0.100 mol/L×0.012L
![]() =
=![]() ,解得:m(CaCO3)=0.06 g,碳酸钙的质量分数为
,解得:m(CaCO3)=0.06 g,碳酸钙的质量分数为![]() ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%;
(3)标况下,17.92mL CO2 的物质的量是![]() =0.0008mol,10mL0.100mol/L NaOH溶液中含有氢氧根离子的物质的量是0.01L×0.100mol/L=0.001mol,根据关系式:CO2~Na2CO3~2OH-、CO2~NaHCO3~OH-,完全生成碳酸钠,需要消耗氢氧根离子0.0008mol×2=0.0016mol>0.001mol;完全生成碳酸氢钠,需要消耗氢氧根离子的物质的量是:0.0008mol<0.001mol,所以溶液中的溶质是碳酸钠和碳酸氢钠的混合物,故答案为:Na2CO3、NaHCO3。
=0.0008mol,10mL0.100mol/L NaOH溶液中含有氢氧根离子的物质的量是0.01L×0.100mol/L=0.001mol,根据关系式:CO2~Na2CO3~2OH-、CO2~NaHCO3~OH-,完全生成碳酸钠,需要消耗氢氧根离子0.0008mol×2=0.0016mol>0.001mol;完全生成碳酸氢钠,需要消耗氢氧根离子的物质的量是:0.0008mol<0.001mol,所以溶液中的溶质是碳酸钠和碳酸氢钠的混合物,故答案为:Na2CO3、NaHCO3。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂,已知一些银盐的颜色和 ![]() 如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×1017 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的
A.KIB.![]() C.KBrD.
C.KBrD.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
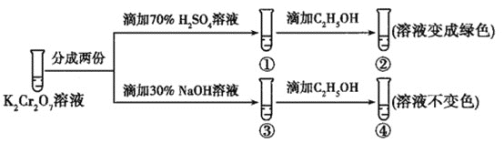
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为___,检验a电极上产生的气体的方法是__,甲电池的总反应化学方程式是___。
(2)在粗铜的电解过程中,图中c电极的材料是___ (填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为___;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是___ (填“铁制品”或“镍块”,下同),f电极的材料是____。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的标准![]() 溶液滴定未知浓度的亚铁溶液,判断以下操作会导致所测亚铁离子浓度偏小的是( )
溶液滴定未知浓度的亚铁溶液,判断以下操作会导致所测亚铁离子浓度偏小的是( )
A.滴定过程中,锥形瓶振荡太剧烈,有少量待测的亚铁溶液溅出
B.读取标准液读数时,滴定前俯视读数,滴定后仰视读数
C.装标准液的滴定管尖嘴部分滴定前有气泡,滴定后无气泡
D.未用标准![]() 溶液润洗滴定管
溶液润洗滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是 ( )
A.常温常压下,124gP4中所含P-P键数目为4NA
B.1L0.1mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.amol的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N-2)NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+ Y(g) ![]() 2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
A. 平衡时,X 的转化率为50%
B. 该温度下平衡常数K=10
C. 10min内生成物Z 的反应速率0.2mol·L-1 ·min-1
D. 某一时刻,X、Y、Z的物质的量分别是0.4mol、0.2mol、1.6mol,此刻V正<V逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com