
| A. | C2H 5OH+3O2═2CO2+3H 2O△H=-29.7 kJ/mol -1 | |
| B. | C2H 5OH(l)+3O2 (g)═2CO2 (g)+3H 2 O(l)△H=+1366.2kJ/mol -1 | |
| C. | C 2 H 5 OH(l)+3O2 (g)═2CO2 (g)+3H 2O(g)△H=+29.7 kJ/mol-1 | |
| D. | C2H 5OH(l)+3O2 (g)═2CO 2 (g)+3H 2 O(l)△H=-1366.2kJ/mol -1 |
分析 依据热化学方程式书写方法写出,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,计算求出46g乙醇完全燃烧放出的热量=29.7KJ×46=1366.2KJ,然后写出热化学方程式.
解答 解:1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:46×29.7kJ=1366.2kJ,
其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1;
故选D.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “两水”都是混合物,溶液中含有的粒子种类、数目相同 | |
| B. | “两水”中存在相同弱电解质的电离 | |
| C. | “两水”都有刺激性气味,都能漂白有机色素 | |
| D. | “两水”放置时间较久后,都会因为相同的原理而变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的所有碳原子不在同一条直线上 | |
| B. | 在光照条件下,可与Cl2发生取代反应 | |
| C. | 丙烷的沸点比丁烷的沸点高,更易液化 | |
| D. | 丙烷难溶于水,且密度小于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
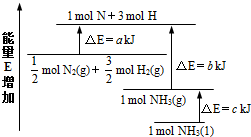 氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.
氨气是氮循环中的重要物质,在人类的生产生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(CH3COOH)>c( CH3COO-) | D. | c(CH3COOH)+c(CH3COO- )=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若不考虑HClO和H20的电离,该溶液中H+的浓度为0.1mol/L | |
| B. | 若在该溶液中加入足量Na0H,则可得到0.1mol的NaClO | |
| C. | 若将此溶液在强光下光照,产生气泡,则气泡主要成分是O2 | |
| D. | 此溶液久置后,由于HClO的大量分解,会导致其pH值升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
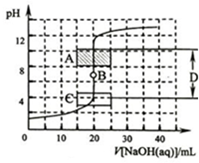 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com