
已知酸H2B在水溶液中存在下列关系:
①H2B=H++HB-,②HB- H++B2-,则下列说法中一定正确的是
H++B2-,则下列说法中一定正确的是
A.NaHB溶液不一定呈酸性,Na2B溶液不一定呈碱性
B.在Na2B溶液中一定有:c(Na+)=2c(B2-)+c(HB-)+c(H2B)
C.NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-)
D.在Na2B溶液中一定有:2c(OH-)=c(H+)+c(HB-)
C
【解析】
试题分析:A、根据电离方程式可知,第一步是完全电离的,而第二步存在电离平衡。所以NaHB溶液中HB-只存在电离,溶液一定呈酸性,Na2B溶液中B2-只水解,溶液一定呈碱性,A不正确;B、根据物料守恒可知在Na2B溶液中一定有:c(Na+)=2c(B2-)+2c(HB-),B不正确;C、根据电荷守恒可知NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),C正确;D、根据质子守恒可知在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-),D不正确,答案选C。
考点:考查电离平衡、水解平衡的应用以及溶液中离子浓度大小比较与关系的正误判断


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
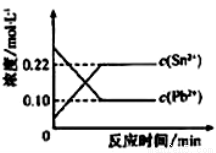
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+
B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3-
C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+
D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:填空题
(8分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]·3H2O。42.2 g K4[Fe(CN)6]·3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。

试回答下列问题:
(1)试确定150 ℃时固体物质的化学式_____________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为_____________________________________________________。
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入含Fe2+、Fe3+的溶液中时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为__________________________。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_____________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关碳酸钠或碳酸氢钠能发生水解的观点正确的是
A.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-,通入CO2,平衡朝正反应方向移动
HCO3-+OH-,通入CO2,平衡朝正反应方向移动
B.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡
C.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低
D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
(改编组合)生活中处处有化学,下列有关说法正确的是
A.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
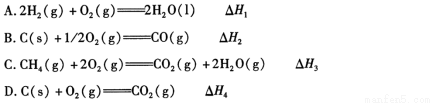
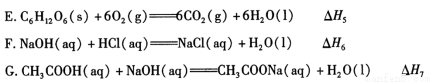
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7 尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
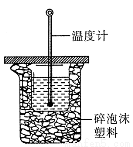
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:实验题
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和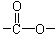 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯(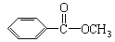 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| 熔点 ℃ | 沸点 ℃ | 水溶性 |
甲醇 | —97.8 | 64.7 | 易溶 |
苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
苯甲酸甲酯 | —12.3 | 198 | 难溶 |
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。
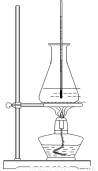
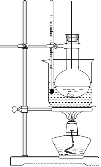
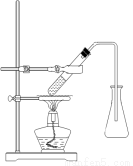
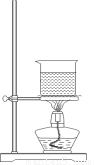
A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.19世纪初,化学家维勒提出了有机化学的概念
B.同位素示踪法是科学家经常使用的研究化学反应历程的手段之一
C.测定有机化合物中碳、氢元素质量分数的方法最早由维特里希提出的
D.甲烷与氯气在光照下发生卤代反应,其机理是甲烷在光照条件下形成自由基(CH3.),甲基自由基与氯气分子发生碰撞,从氯气分子中夺一个氯原子,生成一氯甲烷。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com