
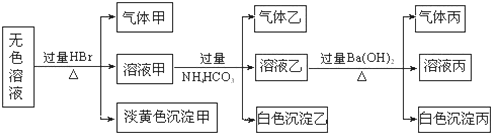


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
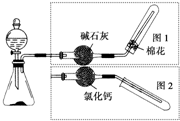 如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )
如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是( )| 发生装置中的药品 | 干燥和集气装置 | |
| A | 铜和稀硝酸 | 图2 |
| B | 氧化钙和浓氨水 | 图2 |
| C | 锌和稀盐酸 | 图1 |
| D | 大理石和稀盐酸 | 图1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
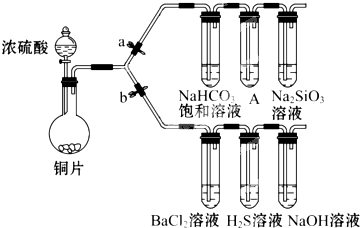 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
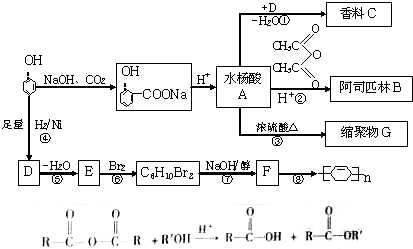
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、找到了新型高效催化剂 |
| B、充分利用了能量 |
| C、提高了纯碱产品的纯度 |
| D、有效减少了环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
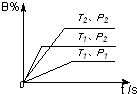 已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )| A、T1<T2,P1>P2,m+n>p,Q>0 |
| B、T1>T2,P1<P2,m+n>p,Q<0 |
| C、T1<T2,P1>P2,m+n<p,Q>0 |
| D、T1>T2,P1<P2,m+n<p,Q>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com