
科目:高中化学 来源: 题型:
| A、气体质量 | B、气体的物质的量 |
| C、分子总数 | D、原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄钾铁矾中铁元素显+3价 |
| B、黄钾铁矾属于碱 |
| C、黄钾铁矾溶于硫酸后,滴加KSCN溶液,溶液变红 |
| D、黄钾铁矾晶体在酒精灯火焰上灼烧,透过蓝色的钴玻璃可观察到紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
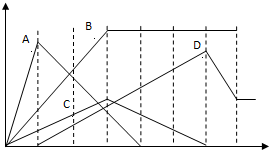 如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表.
如图中,纵坐标为沉淀物的物质的量,横坐标为某溶液中加入反应物的物质的量,试按题意将相应图示的字母填入下表. | 序号 | 实验操作 | 对应编号 |
| ① | 向澄清石灰水中通入CO2至过量 | |
| ② | 向AlCl3溶液中逐滴加入氨水至过量 | |
| ③ | 向含有盐酸的MgCl2、AlCl3溶液中通入NaOH溶液至过量 | |
| ④ | 向NaAlO2溶液中逐滴加入盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
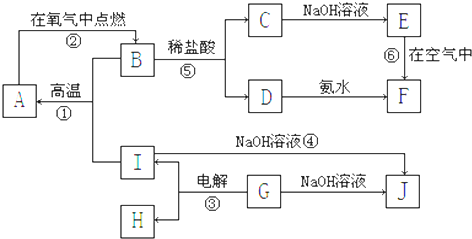
查看答案和解析>>
科目:高中化学 来源: 题型:
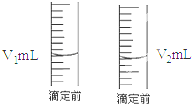 现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、C(H+)和C(OH-)的乘积 | ||
| D、OH-的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com