

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
分析 由元素在周期表中位置,可知①为H,②为C,③为O,④为Na,⑤为Al,⑥为Cl,⑦为Ca,⑧为Ni,⑨为Cu.
(1)⑧号元素核外电子数为28,结合核外电子排布规律书写;与其同周期,且基态原子的核外未成对电子数最多的元素的外围电子排布为3d54s1;
(2)氧化镁、氧化钙均为离子晶体,离子所带电荷相等,离子半径越小,晶格能越大,晶体的熔沸点越高;
(3)①号与③号元素形成的含有18电子的分子为H2O2,该分子中O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为4;
根据均摊法计算晶胞中原子数目,确定化学式;
(4)①同一周期从左至右,随着核电荷数的递增电负性值递增;同族元素从上到下,随着原子半径的增大元素电负性值递减;
②原子半径越大,对电子吸引越弱,电负性越小;
③氯化铝属于共价化合物,Br的电负性小于Cl的,则AlBr3属于共价化合物.
解答 解:由元素在周期表中位置,可知①为H,②为C,③为O,④为Na,⑤为Al,⑥为Cl,⑦为Ca,⑧为Ni,⑨为Cu.
(1)⑧号元素核外电子数为28,基态原子的价电子排布式是3d84s2;与其同周期,且基态原子的核外未成对电子数最多的元素的外围电子排布为3d54s1,为Cr元素,
故答案为:3d84s2;Cr;
(2)氧化镁、氧化钙均为离子晶体,离子所带电荷相等,镁离子半径小于钙离子半径,故MgO的晶格能大于CaO的,故熔点MgO>CaO,
故答案为:MgO>CaO;
(3)①号与③号元素形成的含有18电子的分子为H2O2,该分子中O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为4,O原子采取sp3杂化,
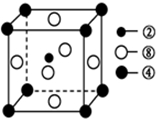
晶胞中C原子数目为1,Ni原子数目为6×$\frac{1}{2}$=3,Mg原子数目为8×$\frac{1}{8}$=1,故化学式为MgNi3C,
故答案为:过氧化氢;sp3;MgNi3C;
(4)①同一周期从左至右,随着核电荷数的递增电负性值递增;同族元素从上到下,随着原子半径的增大元素电负性值递减,N最接近的电负性值范围:2.5<N<3.5,
故答案为:2.5;3.5;
②同周期自左而右原子半径减小、电负性增大,同主族自上而下原子半径增大、电负性减小,可推知半径越大,电负性值越小,
故答案为:半径越大,电负性值越小;
③氯化铝属于共价化合物,Br的电负性小于Cl的,Al与Br的电负性之差更小,则AlBr3属于共价化合物,化学键类型是共价键,
故答案为:共价键.
点评 本题考查结构性质位置关系应用,涉及元素周期表与元素周期律、晶体类型与性质、核外电子排布、杂化方式判断、晶胞计算等,需要学生具备扎实的基础与灵活运用能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH═CH2与HCl加成 | |
| B. | CH3CH2CH2Cl在碱性溶液中水解 | |
| C. | CH2═CH-CH═CH2与H2按物质的量之比为1﹕1进行反应 | |
| D. | 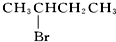 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 甲基的电子式: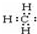 | |
| C. | 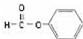 官能团为-COOH 官能团为-COOH | |
| D. | 4-甲基-3-乙基-2-己烯的结构简式为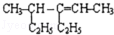 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为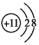 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com