
 在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )
在一定条件下,根据溶液导电性的变化,可以判断出电解质的强弱.已知溶液的导电性与溶液自由移动离子的浓度及其所带电荷有关.离子浓度越大,所带电荷越多,导电性就越强,如图是将KOH溶液分别加入到相同物质的量浓度的HCl溶液和CH3COOH溶液中的导电性变化情况.下列说法正确的是( )| A. | 虚线表示CH3COOH溶液,实线表示HCl溶液 | |
| B. | 由图可知,HCl溶液中加入KOH溶液后导电性将进一步增强 | |
| C. | 由图可知,加入KOH溶液到一定量后,导电性均会比原来强 | |
| D. | 若用NH3•H2O溶液加入到HCl溶液中,则导电性变化如图 |
分析 A、未加氢氧化钾溶液时相同物质的量浓度的HCl溶液的浓度大,导电能力强;
B、HCl溶液中加入KOH溶液,自由移动离子的物质的量不变,溶液体积变大,导电能力减弱;
C、加入KOH溶液到两者恰好完全反应,再加入氢氧化钾溶液溶液中离子浓度增大,导电能力增强;
D、若用NH3•H2O溶液加入到HCl溶液中,在两者恰好完全反应之前导电能力相同,后来再滴入氨水变化不大.
解答 解:A、未加氢氧化钾溶液时相同物质的量浓度的HCl溶液的浓度大,导电能力强,所以实线表示CH3COOH溶液,虚线表示HCl溶液,故A错误;
B、HCl溶液中加入KOH溶液,自由移动离子的物质的量不变,溶液体积变大,自由移动离子浓度减小,导电能力减弱,故B错误;
C、加入KOH溶液到两者恰好完全反应,再加入氢氧化钾溶液溶液中离子浓度增大,导电能力增强,所以加入KOH溶液到一定量后,导电性均会比原来强,故C正确;
D、若用NH3•H2O溶液加入到HCl溶液中,在两者恰好完全反应之前导电能力相同,后来再滴入氨水变化不大,不是明显升高,故D错误;
故选C.
点评 本题考查了醋酸的电离和溶液的导电性,关键抓住导电性最强说明刚好完全反应,难度不大,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入稀盐酸无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )
R、X、Y、Z、A是短周期主族元素,它们在元素周期表中的相对位置如图所示.X原子最外层电子数等于电子层数的3倍.下列推断正确的是( )| A. | 最简单气态氢化物的热稳定性由强到弱的排序:Z、R、X、Y | |
| B. | 原子半径由小到大的排序:Z、A、Y、X | |
| C. | 最高价氧化物的水化物酸性由弱到强的排Z、R、A | |
| D. | RY3、A2X、ZA5分子中每个原子最外层都达到8 电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
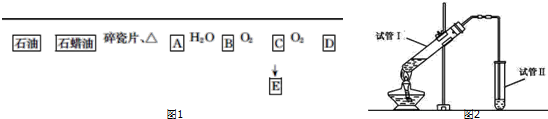
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
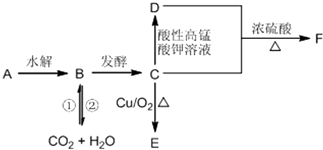
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
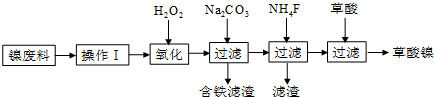
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2、CO2、H2O、HBr | B. | CO2、O2、H2S、HCl | ||
| C. | Na2O2、S8、CO2、H2O | D. | CO2、H2S、H2O、HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com