
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
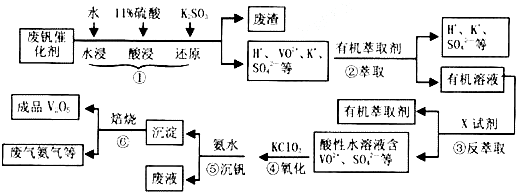
分析 废钒催化剂经过水浸、酸浸、加入亚硫酸钾还原,该过程中二氧化硅不溶于水、不反应,过滤分离,得到废渣为二氧化硅,滤液中含有H+、VO2+、K+、SO42-等,在滤液中加入有机萃取剂萃取滤液中VO2+,通过分液得到含有VO2+的有机层,加入试剂X进行反萃取,结合(2)中步骤②、③的变化为可逆过程,可知X为硫酸,加入硫酸分液得到有机层和水层,由加入氨水调节pH得到的沉淀,结合(3)中可知加入氧化剂KClO3氧化VO2+为VO3+,结合(4)中得到钒沉淀率和溶液pH之间关系,可知pH应调节在1.7~1.8,最后沉淀分解得到氨气和V2O5,由工艺流程可知,氨气与有机溶剂可以循环利用.
(1)钒催化剂经过水浸、酸浸、加入亚硫酸钾还原,该过程中二氧化硅不溶于水、不反应,过滤得到滤渣为二氧化硅;③中反萃取时加入的X试剂是抑制平衡正向进行;
(2)②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
(3)KClO3氧化VO2+为VO3+,ClO3-被还原为Cl-,结合电荷守恒、原子守恒配平;
(4)根据钒沉淀率最高确定溶液pH;
(5)某一步骤中用到的物质,再其它步骤可以生成,该物质可以循环利用.
解答 解:废钒催化剂经过水浸、酸浸、加入亚硫酸钾还原,该过程中二氧化硅不溶于水、不反应,过滤分离,得到废渣为二氧化硅,滤液中含有H+、VO2+、K+、SO42-等,在滤液中加入有机萃取剂萃取滤液中VO2+,通过分液得到含有VO2+的有机层,加入试剂X进行反萃取,结合(2)中步骤②、③的变化为可逆过程,可知X为硫酸,加入硫酸分液得到有机层和水层,由加入氨水调节pH得到的沉淀,结合(3)中可知加入氧化剂KClO3氧化VO2+为VO3+,结合(4)中得到钒沉淀率和溶液pH之间关系,可知pH应调节在1.7~1.8,最后沉淀分解得到氨气和V2O5,由工艺流程可知,氨气与有机溶剂可以循环利用.
(1)钒催化剂经过水浸、酸浸、加入亚硫酸钾还原,该过程中二氧化硅不溶于水、不反应,过滤得到滤渣为二氧化硅;
③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,
故答案为:SiO2;H2SO4;
(2)②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行,提高了钒的萃取率,故答案为:加入碱中和硫酸使平衡正移;
(3)KClO3氧化VO2+为VO3+,ClO3-被还原为Cl-,配平后离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,故答案为:6;6;6;1;3H2O;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7~1.8,此时钒沉淀率达到最大,故答案为:1.7~1.8;
(5)由工业流程图可知,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂、氨气.
点评 本题考查实验制备方案,关键是理解化学工艺流程,注意根据流程图结合题目问题分析,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| B | AgCl难溶于酸 | 用盐酸和AgNO3溶液检验Cl- |
| C | Ba(OH)2易溶于水 | 可配制1.0mol?L-1的Ba(OH)2溶液 |
| D | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 初始浓度/(mol•L-1) | 初始速率/mol•L-1s-1 | |
| c(NO) | c(O2) | |
| 0.010 | 0.010 | 2.5×10-3 |
| 0.010 | 0.020 | 5.0×10-1 |
| 0.030 | 0.020 | 4.5×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 几种物质溶解度与温度的关系 | |||||
| 温度 | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | |||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时增大 | B. | 同时减小 | C. | 增大,减小 | D. | 减小,增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和晶体硫的熔融 | B. | 石墨和食盐的熔化 | ||
| C. | 晶体碘和晶体二氧化碳的升华 | D. | 冰的融化和硝酸钠的熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com