
| +O2 |
| +O2 |
| +H2O |
| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| ||
| 1.92g |
| 64g/mol |
| 0.03mol×2 |
| 4 |
| B |
| B |


科目:高中化学 来源: 题型:
| A、三种溶液pH的大小顺序是①>③>② |
| B、三种溶液中由水电离出的OH-浓度的大小顺序是①>②>③ |
| C、若将三种溶液稀释相同倍数,pH变化最大的是③ |
| D、若分别加入10mL 0.1mol?L-1盐酸后,pH最大的是② |
查看答案和解析>>
科目:高中化学 来源: 题型:
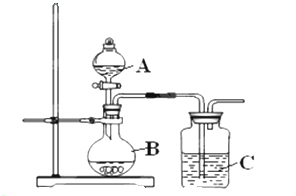 Ⅰ、某同学想通过下列实验装置来验证硫、碳、硅的非金属性的强弱,则A中的药品是
Ⅰ、某同学想通过下列实验装置来验证硫、碳、硅的非金属性的强弱,则A中的药品是| 实验序号 | 温度 | H2O2溶液初始浓度 | MnO2颗粒大小 |
| 1 | 25℃ | 4% | 无MnO2 |
| 2 | 25℃ | 12% | 1g细颗粒MnO2 |
| 3 | 25℃ | 4% | 1g细颗粒MnO2 |
| 4 | 25℃ | 4% | 1g粗颗粒MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
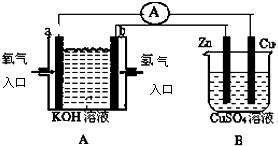
查看答案和解析>>
科目:高中化学 来源: 题型:
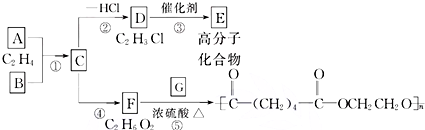
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| NH3?H2O |
| △ |
| NH3?H2O |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
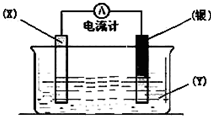 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com