
等质量的四份镁铝合金粉末分别与下列过量的溶液充分反应,放出氢气最多的是
A.NaOH B.稀H2SO4
C.蔗糖 D.NaCl
科目:高中化学 来源:2014-2015学年福建省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列各组液体混合物,能用分液漏斗分离的是
A.溴苯和溴 B.苯和硝基苯 C.正己烷和水 D.酒精和水
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3- )>c(CO32 -)>c(H2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)= c(HCO3- )+2c(H2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:c(CO32 -)>c(HCO3- )>c(OH-)>c(H+)
D.CH3COONa和CH3COOH混合溶液一定存在:c(Na+)= c(CH3COO-)=c(CH3COOH)>c(H+)= c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高二12月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.反应NH3(g)+HCl(g)  NH4C1(s) ΔH<O在任何条件下均能自发进行
NH4C1(s) ΔH<O在任何条件下均能自发进行
B.对于可逆反应N2(g)+3H2(g)  2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.将A1C13溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为A1203
D.恒容密闭容器中进行的反应3A(g)  B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第三次月考化学试卷(解析版) 题型:选择题
有下列四组物质,如果把某组物质中的后者逐滴加人到前者中至过量,将出现“先产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A.稀硫酸、氯化钡溶液 B.硫酸铝溶液、氨水
C.氯化钠溶液、硝酸银溶液 D.氯化铝溶液、氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列反应观察不到“既有沉淀析出,又有气体产生”现象的是
A.金属钠和硫酸铜溶液 B.过氧化钠和氯化镁溶液
C.氧化钠和氯化铵溶液并加热 D.硫酸铵和氢氧化钡溶液并加热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:实验题
(10分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_____________________________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。


分析上图能够得出的实验结论是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.对于2SO2(g)+O2(g) 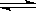 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B.Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海理工大学附中高三上学期月考化学试卷(解析版) 题型:选择题
现有下列短周期元素性质的数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
下列说法正确的是
A.原子序数④元素大⑦元素
B.②、③处于同一周期
C.上述八种元素最高价氧化物对应的水化物,⑤号酸性最强
D.⑧号元素原子结构示意图为: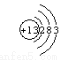
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com