
【题目】硼、铁、镍及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态铁原子的外围电子排布式为__________。
(2)NaBH4、LiBH4常作有机合成的还原剂。LiBH4中B原子的杂化方式为________;BH4-的空间构型为____________。
(3)NiO、FeO的晶体类型相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm。熔点:FeO_____NiO(填“>”、“<”或“=”),理由是____________。
(4)镍能形成多种配合物,如Ni(CO)4、[Ni(NH3)6]2+等。[Ni(NH3)6]2+中,Ni2+的配位数为_________;在Ni(CO)4中提供孤电子对的原子是C,不是O,可能的原因是_________。
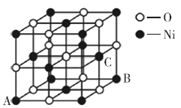
(5)氧化镍晶胞如图所示,镍离子的配位数为__________。已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为__________g·cm-3。
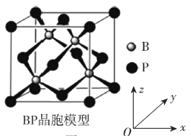
(6)磷化硼晶体结构类似金刚石,是一种耐磨材料,常作金属涂层,其晶胞如图所示。磷化硼晶胞沿z轴的平面投影图中,B原子构成的几何形状是__________。
【答案】3d64s2 sp3 正四面体 < NiO、FeO均为离子晶体,O2-相同,阳离子所带电荷数相同,Ni2+半径较小,NiO的晶格能较大,熔点较高 6 氧的电负性大于碳,提供孤对电子的能力比碳弱 6 ![]() 正方形
正方形
【解析】
铁的核外电子数为26;B原子与4个H原子形成4个σ键;分子的晶格能越大,熔点越高。
(1)Fe为26号元素,原子核外有26个电子,外围电子排布式为3d64s2。
(2)B原子价层电子对个数=![]() 且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化方式为sp3,BH4-的空间构型为正四面体。
且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化方式为sp3,BH4-的空间构型为正四面体。
(3)NiO、FeO均为离子晶体,离子半径越小,离子所带电荷越多,晶格能越大,熔点越高。Ni2+、Fe2+所带电荷数相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm,离子半径:Ni2+<Fe2+,晶格能NiO>FeO,故熔点:FeO<NiO(填“>”、“”或“=”)。
(4)[Ni(NH3)6]2+中,Ni2+的配位数为6;在Ni(CO)4中,氧的电负性大于碳,C对孤电子吸引力较小,易提供孤对电子。
(5)氧化镍晶胞是面心立方堆积,类似氯化钠晶胞,镍离子的配位数为6。1个晶胞中O原子的个数为![]() ,Ni原子个数为
,Ni原子个数为![]() ,故1个晶胞中含4个NiO,氧化镍晶体的密度
,故1个晶胞中含4个NiO,氧化镍晶体的密度![]() 。
。
(6)磷化硼晶胞中,P原子将晶胞分成8个小立方体,4个B原子分别位于4个互不相邻的小立方体中心,构成正四面体。故沿z轴的平面投影图中,B原子构成的几何形状是正方形。


科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______.实验中不能用干燥空气代替干燥N2,原因是______________
(2)如将装置B改为装置C(图2),可能会导致的后果是___________________
(3)步骤3中,第一次过滤除去的物质是_________________.
(4)有关步骤4的说法,正确的是__________________.
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是_____________________________.
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________________(以质量分数表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
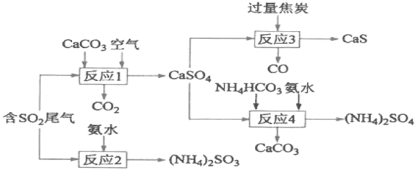
(1)反应1的化学方程式为________________;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________;
(4)整个合成路线中可以循环利用的物质是_____________;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂离子电池,放电时电池反应为2Li+MgH2=Mg+2LiH,装置如图所示。下列说法不正确的是:
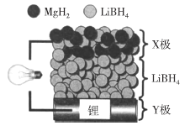
A.放电时,化学能只转化为电能B.放电时,X极的反应式为MgH2+2e-=Mg+2H-
C.充电时,Li+向Y极迁移D.充电时,理论上转移0.2NA个电子Y极增重1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A的产量是衡量一个国家石油化工发展水平的标志。B和D是生活中两种常见的有机物,F是高分子化合物。相互转化关系如图所示:
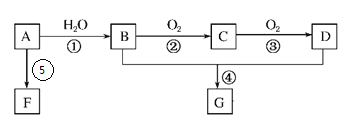
已知:![]()
(1)A分子的结构简式为_____________;B中官能团名称为_____________。
(2)在反应①~⑤中,属于加成反应的是______,属于取代反应的是______(填序号)。
(3)写出下列反应的化学方程式:
④B+D→G:_______________________;
⑥A→F:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)![]() Z(g)+W(s) ΔH= -Q kJ·mol-1,下列叙述中,正确的是( )
Z(g)+W(s) ΔH= -Q kJ·mol-1,下列叙述中,正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到平衡,用CO2表示该反应的平均速率ν(CO2)=________mol/(Lmin);
(2)平衡时氢气的物质的量浓度为_______mol/L;
(3)该条件下该反应的平衡常数K=_______;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_______;
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
(5)当达到平衡时,不再维持恒容,充入氩气保持压强不变,平衡将_______(填“正向”、“逆向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①⑩十种元素在周期表中的位置。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑥ | ⑨ | |||
4 | ② | ⑦ | ⑩ |
(1)①~⑩中金属性最强的元素为____________(写名称)。
(2)①、⑧两种元素形成的化合物,在高温下灼烧,火焰呈____________色。
(3)⑦、⑨两种元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(4)①、⑥、⑧、⑨四种元素形成的简单离子半径由大到小的顺序依次是____________span>。(用微粒符号来表示)
(5)⑤元素的氢化物实验室制法的化学方程式是____________。
(6)⑤、⑨的气态氢化物在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(7)下列说法正确的是____________(填字母)。
a.⑥的非金属性强于⑦ b.氢化物稳定性:⑦<⑩ c.③单质与水反应比单质①剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) ![]() N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com