
| A、常温常压下,22.4L CO2中含有NA个CO2分子 |
| B、17.6g丙烷中所含的极性共价键为4NA个 |
| C、1.7g H2O2中含有的电子数为0.9NA |
| D、在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
| 17.6g |
| 44g/mol |
| 1.7g |
| 34g/mol |


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
| A、用NaOH溶液可以除去乙酸乙酯中的乙酸 |
| B、乙烯和苯都能与溴水反应而使溴水褪色 |
| C、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| D、脂肪、糖类和蛋白质都是人体重要的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素的原子半径:A<B<C<D |
| B、四种元素A、B、C、D的氧化物都不止一种 |
| C、由B与A组成的化合物的沸点一定低于由C与A组成的化合物的沸点 |
| D、CaA2、CaB2这两种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z |
| A、①②③④ | B、①②④ |
| C、②④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
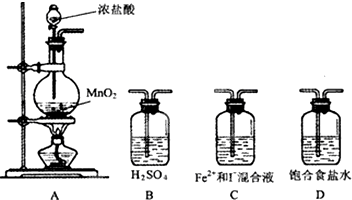 某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱.| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加 向B试管中滴加 | ①若 ②若 ③若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol NaHSO4晶体含有2NA个离子 |
| B、1L2mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA个 |
| C、1mol CH3+(碳正离子)中含有的电子数为10NA |
| D、在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新型合成氨方法是吸热反应 |
| B、新型合成氨方法可简化生产设备 |
| C、新型催化剂提高了N2和H2的转化率 |
| D、两种方法中该反应的化学平衡常数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
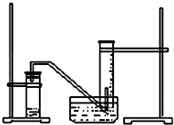 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如图请回答:(1)进行此试验时,必须保证气密性良好,如何检验此装置的气密性?查看答案和解析>>
科目:高中化学 来源: 题型:
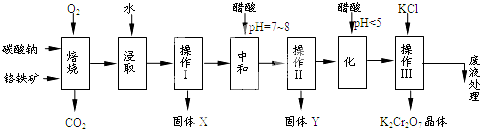
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0℃ | 40℃ | 80℃ | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O | 163 | 215 | 376 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com